摘要:4.钠和氧气的反应 (1)实验过程:①②③④⑤⑥⑦ 钠与氧气的反应 图2-9 (2)反应原理:2Na+O2Na2O2.2Na2O2+2H2O=4NaOH+O2↑ (3)注意事项 ①玻璃管中装的钠不能太大.太大反应太剧烈.会将玻璃管炸裂. ②反应开始时.即钠熔成小球后要稍稍倾斜玻璃管.但是角度不能太大.以防止钠从玻璃管中脱出.并能保证空气疏通从而观察到明显现象. ③在取钠时要将其表面的氧化物用小刀除去.用纯钠进行实验.因为表面被氧化的钠在受热熔化后.钠表面会有一层黑色而影响实验现象的观察. ④加热时间不能太长.否则钠与O2迅速反应.燃烧起来.现象就不是很明显了. ⑤盛Na2O2的小试管要干燥. (4)实验现象 钠熔成小球.先变成白色后变成淡黄色固体.淡黄色固体遇水放出使带火星木条复燃的气体. (5)实验结论 钠熔点低.与O2加热反应生成Na2O2.Na2O2遇水生成O2.
网址:http://m.1010jiajiao.com/timu_id_4459321[举报]
实验室制备1,2-二溴乙烷的反应原理如下:

可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在
(5)若产物中有少量未反应的Br2,最好用
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用
(7)反应过程中应用冷水冷却装置D,其主要目的是
查看习题详情和答案>>

可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是
d
d
;(填正确选项前的字母)a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入
c
c
,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是
溴的颜色完全褪去
溴的颜色完全褪去
;(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在
下
下
层(填“上”、“下”);(5)若产物中有少量未反应的Br2,最好用
b
b
洗涤除去;(填正确选项前的字母)a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用
蒸馏
蒸馏
的方法除去;(7)反应过程中应用冷水冷却装置D,其主要目的是
乙烯与溴反应时放热,冷却可避免溴的大量挥发
乙烯与溴反应时放热,冷却可避免溴的大量挥发
;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
.实验室模拟合成氨和氨催化氧化的流程如下:?
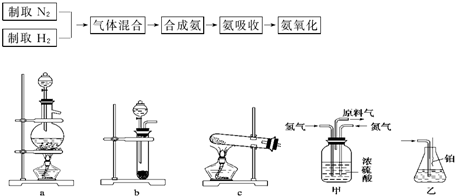
已知
A.实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
B.锥形瓶中的铂丝是氨催化氧化反应的催化剂
(1)从上图中选择制取气体的合适装置:氮气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还可以
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、
查看习题详情和答案>>

已知
A.实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
B.锥形瓶中的铂丝是氨催化氧化反应的催化剂
(1)从上图中选择制取气体的合适装置:氮气
a
a
、氢气b
b
.(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还可以
干燥气体
干燥气体
、控制氢气和氮气的流速
控制氢气和氮气的流速
.(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
不会
不会
(“会”或“不会”)发生倒吸,原因是因为混合气体中含有大量难溶于水的氮气、氢气两种气体
因为混合气体中含有大量难溶于水的氮气、氢气两种气体
.(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
表明氨的催化氧化反应是一个放热反应
表明氨的催化氧化反应是一个放热反应
,锥形瓶中还可观察到的现象是:有红棕色气体产生?
有红棕色气体产生?
.(5)写出乙装置中氨氧化的化学方程式:
4NH3+5O2
4NO+6H2O?
| ||
| △ |
4NH3+5O2
4NO+6H2O?
.
| ||
| △ |
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、
NH4+
NH4+
、NO3-
NO3-
离子.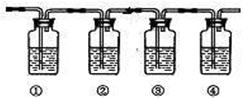 实验室制乙烯通常采用乙醇与浓硫酸(体积比为1:3)混合加热到170℃制得,反应过程中乙醇常被炭化,溶液中有黑色物质出现,随着反应进行炭化现象越来越严重,同时制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,可让混合气体依次通过如图实验装置.(可供选择的试剂:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾溶液、浓硫酸,试剂可重复使用.)
实验室制乙烯通常采用乙醇与浓硫酸(体积比为1:3)混合加热到170℃制得,反应过程中乙醇常被炭化,溶液中有黑色物质出现,随着反应进行炭化现象越来越严重,同时制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,可让混合气体依次通过如图实验装置.(可供选择的试剂:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾溶液、浓硫酸,试剂可重复使用.)A.①②中盛放的试剂分别为①
品红
品红
; ②NaOH溶液
NaOH溶液
;(填试剂名称)B.能说明二氧化硫气体存在的现象是
装置①中品红褪色
装置①中品红褪色
.C.能确认含有乙烯的现象是
装置③中品红不褪色,装置④中溶液褪色
装置③中品红不褪色,装置④中溶液褪色
.实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气.供选用的实验试剂及装置如下(部分导管、蒸馏水略):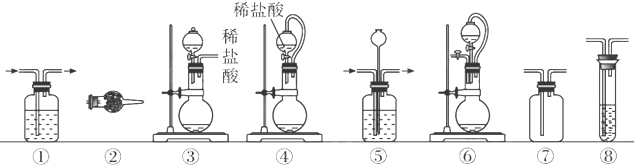
a、Na2O2 b、浓盐酸 c、碱石灰 d、NaOH溶液 e、淀粉-KI溶液 f、CaCO3
g、石蕊试液 h、饱和NaCl溶液
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式
(2)下列装置组合最合理的是
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为:
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①
②
查看习题详情和答案>>

a、Na2O2 b、浓盐酸 c、碱石灰 d、NaOH溶液 e、淀粉-KI溶液 f、CaCO3
g、石蕊试液 h、饱和NaCl溶液
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式
Na2O2+4HCl═2NaCl+Cl2↑+2H2O
Na2O2+4HCl═2NaCl+Cl2↑+2H2O
.(2)下列装置组合最合理的是
D
D
(填序号,需考虑实验结束撤除装置时残留有害气体的处理).| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①
Na2O2能与水反应,会使原料的利用率降低
Na2O2能与水反应,会使原料的利用率降低
,②
双氧水比Na2O2更经济
双氧水比Na2O2更经济
.实验室里化学兴趣小组探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液,接下来的流程如下:(每一步反应均充分)

(1)指出过程中有关的实验操作①和②名称:①
(2)选择试剂①时,若要考虑实验尽量不放出有害气体,可选择
A.氯气 B.氟化钠 C.稀硫酸 D.次氯酸钠
实验指导教师则给出了10%H2O2和2mol/L稀硫酸,请写出碘离子与这些物质发生反应的离子方程式:
(3)选择试剂②,可供选择的试剂是
A.酒精 B.CCl4C.苯 D.氢氧化钠
(4)在操作②过程中:①分液漏斗中上层液体从
②要检验在操作②后水溶液中是否含碘单质的方法:
(5)有色液体呈
①温度计水银球位置错误 ②冷却水的方向错 ③酒精灯加热错 ④烧杯直接加热错.

查看习题详情和答案>>

(1)指出过程中有关的实验操作①和②名称:①
过滤
过滤
,②分液
分液
.(2)选择试剂①时,若要考虑实验尽量不放出有害气体,可选择
D
D
A.氯气 B.氟化钠 C.稀硫酸 D.次氯酸钠
实验指导教师则给出了10%H2O2和2mol/L稀硫酸,请写出碘离子与这些物质发生反应的离子方程式:
2I-+2H++H2O2=I2+2H2O
2I-+2H++H2O2=I2+2H2O
(3)选择试剂②,可供选择的试剂是
BC
BC
.A.酒精 B.CCl4C.苯 D.氢氧化钠
(4)在操作②过程中:①分液漏斗中上层液体从
上口倒出
上口倒出
.②要检验在操作②后水溶液中是否含碘单质的方法:
取少量溶液加入淀粉溶液看溶液是否变蓝.若变蓝则有碘
取少量溶液加入淀粉溶液看溶液是否变蓝.若变蓝则有碘
.(5)有色液体呈
紫色或紫红
紫色或紫红
色.从此液体中提取碘和回收有机溶剂,还需要经过蒸馏过程.指出下图蒸馏实验装置中的错误是①②④
①②④
①温度计水银球位置错误 ②冷却水的方向错 ③酒精灯加热错 ④烧杯直接加热错.
