题目内容
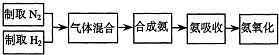
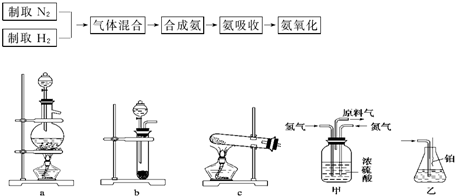
实验室模拟合成氨和氨催化氧化的流程如下:?
已知
A.实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
B.锥形瓶中的铂丝是氨催化氧化反应的催化剂
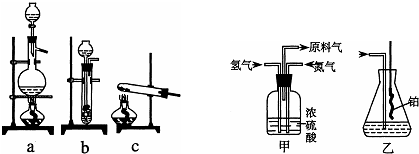
(1)从上图中选择制取气体的合适装置:氮气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还可以
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、

已知
A.实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
B.锥形瓶中的铂丝是氨催化氧化反应的催化剂
(1)从上图中选择制取气体的合适装置:氮气
a
a
、氢气b
b
.(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还可以
干燥气体
干燥气体
、控制氢气和氮气的流速
控制氢气和氮气的流速
.(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
不会
不会
(“会”或“不会”)发生倒吸,原因是因为混合气体中含有大量难溶于水的氮气、氢气两种气体
因为混合气体中含有大量难溶于水的氮气、氢气两种气体
.(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
表明氨的催化氧化反应是一个放热反应
表明氨的催化氧化反应是一个放热反应
,锥形瓶中还可观察到的现象是:有红棕色气体产生?
有红棕色气体产生?
.(5)写出乙装置中氨氧化的化学方程式:
4NH3+5O2
4NO+6H2O?
| ||
| △ |
4NH3+5O2
4NO+6H2O?
.
| ||
| △ |
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、
NH4+
NH4+
、NO3-
NO3-
离子.分析:(1)根据制取气体的药品状态和条件选择合适的制取仪器;
(2)甲装置中通过冒气泡的速率来控制气体流量;
(3)合成氨的反应是可逆的,还会有一些氮气、氢气存在,据此来回答;
(4)氨的催化氧化是一个放热过程,一氧化氮遇空气就变为二氧化氮,二氧化氮是红棕色气体;
(5)氨的催化氧化生成一氧化氮和水;
(6)根据溶液的组成来确定含有的离子.
(2)甲装置中通过冒气泡的速率来控制气体流量;
(3)合成氨的反应是可逆的,还会有一些氮气、氢气存在,据此来回答;
(4)氨的催化氧化是一个放热过程,一氧化氮遇空气就变为二氧化氮,二氧化氮是红棕色气体;
(5)氨的催化氧化生成一氧化氮和水;
(6)根据溶液的组成来确定含有的离子.
解答:解:(1)实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,可以选择a,实验室里用金属锌粒和稀硫酸反应制取氢气,可以选择装置b,
故答案为:a;b;
(2)氮气和氢气通过甲装置,甲装置中的浓硫酸可以将氮气和氢气干燥,同时可以根据甲装置中冒气泡的速率来控制气体流量,故答案为:干燥气体;控制氢气和氮气的流速;
(3)合成氨的反应是可逆的,还会有一些氮气、氢气存在,这样会缓解氨气极易溶于水导致的气压差,不会倒吸,故答案为:因为混合气体中含有大量难溶于水的氮气、氢气两种气体;
(4)氨的催化氧化反应是一个放热反应,将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热,同时氨催化氧化产物一氧化氮极易变为二氧化氮,二氧化氮是红棕色气体,
故答案为:表明氨的催化氧化反应是一个放热反应;有红棕色气体产生;
(5)氨的催化氧化反应产物是一氧化氮和水,即4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(6)氨的催化氧化反应产物是一氧化氮和水,一氧化氮极易变为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,所以硝酸的存在会和氨水反应生成硝酸铵,溶液中会存在H+、OH-、NH4+、NO3-,故答案为:NH4+;NO3-.
故答案为:a;b;
(2)氮气和氢气通过甲装置,甲装置中的浓硫酸可以将氮气和氢气干燥,同时可以根据甲装置中冒气泡的速率来控制气体流量,故答案为:干燥气体;控制氢气和氮气的流速;
(3)合成氨的反应是可逆的,还会有一些氮气、氢气存在,这样会缓解氨气极易溶于水导致的气压差,不会倒吸,故答案为:因为混合气体中含有大量难溶于水的氮气、氢气两种气体;
(4)氨的催化氧化反应是一个放热反应,将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热,同时氨催化氧化产物一氧化氮极易变为二氧化氮,二氧化氮是红棕色气体,
故答案为:表明氨的催化氧化反应是一个放热反应;有红棕色气体产生;
(5)氨的催化氧化反应产物是一氧化氮和水,即4NH3+5O2
| ||
| △ |
| ||
| △ |
(6)氨的催化氧化反应产物是一氧化氮和水,一氧化氮极易变为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,所以硝酸的存在会和氨水反应生成硝酸铵,溶液中会存在H+、OH-、NH4+、NO3-,故答案为:NH4+;NO3-.
点评:本题是一道关于氨气的制取和性质知识的综合题目,要求学生具有分析和解决问题的能力,综合性强.难度大.

练习册系列答案
相关题目