摘要:12.原子序数为94的钚(Pu)是一种核原料.该元素一种原子的质子数和中子数之和为239.下 列关于该原子的说法不正确的是 A.中子数为145 B.核外电子数为94 C.质子数为94 D.核电荷数为239
网址:http://m.1010jiajiao.com/timu_id_4456696[举报]
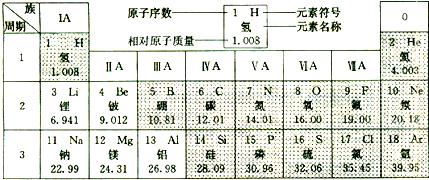
下图是元素周期表中的一部分.在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.请回答:

(1)硅的相对原子质量为
(2)原子半径:钠
(3)表中属于金属元素的有
(4)元素周期表是根据原子序数按顺序排列的.原子序数=
(5)分别画出16号元素原子的结构示意图:
 ;11号元素原子结构示意图
;11号元素原子结构示意图
 ;由16号元素和11号元素组成的化合物化学式为:
;由16号元素和11号元素组成的化合物化学式为:
查看习题详情和答案>>

(1)硅的相对原子质量为
28.09
28.09
;原子序数为8的元素位于元素周期表的第2
2
周期,元素符号为O
O
,它属于非金属
非金属
(填“金属”或“非金属”)元素.(2)原子半径:钠
>
>
镁(填“>”或“═”或“<”,下同),原子得电子能力:硫<
<
氯.(3)表中属于金属元素的有
Li、Be、Na、Mg、Al
Li、Be、Na、Mg、Al
(填元素符号)(4)元素周期表是根据原子序数按顺序排列的.原子序数=
质子
质子
数=核电荷
核电荷
数.不同元素的本质区别在于质子数
质子数
不同.(5)分别画出16号元素原子的结构示意图:




Na2S
Na2S
.23、下图是元素周期表中的一部分.
在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.请回答:
(1)硅的相对原子质量为
(2)原子半径:钠
(3)与钠元素化学性质相似的元素为
(4)分析上表可发现:每一横行元素从左向右排列所遵循的一条规律是
查看习题详情和答案>>

在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.请回答:
(1)硅的相对原子质量为
28.09
;原子序数为8的元素位于元素周期表的第
2
周期,元素符号为
O
,它属于
非金属
(填“金属”或“非金属”)元素.(2)原子半径:钠
>
镁(填“>”或“═”或“<”,下同),原子得电子能力:硫
<
氯.(3)与钠元素化学性质相似的元素为
锂
.(4)分析上表可发现:每一横行元素从左向右排列所遵循的一条规律是
每一横行,质子数逐渐增大
.