摘要:根据近年来化学高考试题中有关化学实验内容的题目分析.下列内容是化学实验部分考查的重点: l.实验基本操作和技能 这类试题的特点通常是给出限定的仪器.药品和一些操作步骤.要求正确完成某项实验操作.既有常见仪器的使用方法.又有基本操作的正误辨别.着重考查考生对中学化学实验基本操作技能掌握的情况.题目的难度不高.但并不容易得满分.2.正确运用实验原理和正确认识实验装置 这类试题通常是给出限定的实验装置.反应条件.实验现象和有关数据.要求考生根据实验原理及试题中所给予的信息.结合元素化合物知识.选用仪器药品.正确认识.选择装置.说明装置中某些仪器的作用.描述实验现象.写有关化方程式.进行数据分析.指出实验中必须注意的某些问题等等.主要考查考生的观察能力与分析综合及评价的能力.这类题目具有一定的综合性.具有较大的区分度.
网址:http://m.1010jiajiao.com/timu_id_4452317[举报]
(2012?南京模拟)“氢能”将是未来最理想的新能源.
(1)实验测得,1g H2(g)燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
CaO+2HBr ②2HBr+Hg
HgBr2+H2
③HgBr2+
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式
根据“绿色化学”的思想评估该方法制H2的主要缺点
(3)氢气通常用生产水煤气的方法制得.其中:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
②850℃时,若向一容积可变的密闭容器中同时充入 1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
(4)工业生产中,常用氢氧化钠溶液吸收排放废气中的二氧化硫,并将吸收产物电解,可以产生氢气、
硫酸等物质,装置如图1所示.该电解过程中阳极的电极反应式为
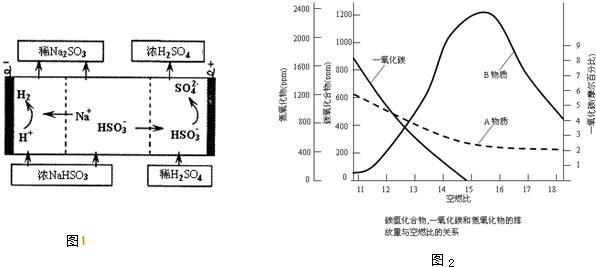
(5)一氧化碳、氮氧化物和碳氢化合物是汽车尾气的主要成分.已知空燃比(空气、燃料体积之比)与尾气中各成分排放量关系如图2所示.B物质的名称是
查看习题详情和答案>>
(1)实验测得,1g H2(g)燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol
H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol
.(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
| ||
| ||
③HgBr2+
CaO
CaO
| ||
HgO
HgO
+CaBr2
CaBr2
④2HgO
| ||
请你根据“原子经济”的思想完成上述步骤③的化学方程式
HgBr2+CaO
HgO+CaBr2
| ||
HgBr2+CaO
HgO+CaBr2
.
| ||
根据“绿色化学”的思想评估该方法制H2的主要缺点
循环过程需要很高的能量,且使用重金属汞,产生污染
循环过程需要很高的能量,且使用重金属汞,产生污染
.(3)氢气通常用生产水煤气的方法制得.其中:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
小于
小于
1(填“大于”、“小于”或“等于”).②850℃时,若向一容积可变的密闭容器中同时充入 1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
0≤x<3
0≤x<3
.(4)工业生产中,常用氢氧化钠溶液吸收排放废气中的二氧化硫,并将吸收产物电解,可以产生氢气、
硫酸等物质,装置如图1所示.该电解过程中阳极的电极反应式为
HSO3-+H2O-2e-=SO42-+3H+
HSO3-+H2O-2e-=SO42-+3H+
.
(5)一氧化碳、氮氧化物和碳氢化合物是汽车尾气的主要成分.已知空燃比(空气、燃料体积之比)与尾气中各成分排放量关系如图2所示.B物质的名称是
氮氧化物
氮氧化物
.(2007?惠州模拟)科学家预测“氢能”将是未来最理想的新能源.请回答下列问题:
(1)实验测得,1克氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ/mol
B.H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.H2(g)+1/2O2(g)=H2O(g);△H=-285.8kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2+H2O
CaO+2HBr ②2HBr+Hg
HgBr2+H2↑
③HgBr2+CaO
HgO+CaBr2 ④2HgO
2Hg+O2↑
上述过程的总反应可表示为
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题.下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘.

请写出反应①的化学方程式:
用硫-碘热循环法制取氢最大的优点是
(4)也有人认为利用氢气作为能源不太现实.你的观点呢?请说明能够支持你的观点的两点理由
查看习题详情和答案>>
(1)实验测得,1克氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为
B
B
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ/mol
B.H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.H2(g)+1/2O2(g)=H2O(g);△H=-285.8kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2+H2O
| ||
| ||
③HgBr2+CaO
| ||
| ||
上述过程的总反应可表示为
2H2O 2H2↑+O2↑
2H2↑+O2↑
 2H2↑+O2↑
2H2↑+O2↑2H2O 2H2↑+O2↑
2H2↑+O2↑
. 2H2↑+O2↑
2H2↑+O2↑(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题.下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘.

请写出反应①的化学方程式:
SO2+I2+2H2O 2HI+H2SO4
2HI+H2SO4
 2HI+H2SO4
2HI+H2SO4SO2+I2+2H2O 2HI+H2SO4
2HI+H2SO4
. 2HI+H2SO4
2HI+H2SO4用硫-碘热循环法制取氢最大的优点是
SO2和I2可循环使用,无污染.
SO2和I2可循环使用,无污染.
.(4)也有人认为利用氢气作为能源不太现实.你的观点呢?请说明能够支持你的观点的两点理由
不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难.(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等.)
不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难.(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等.)
.乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一:
工艺二: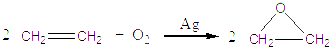
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率 (填高或低);工艺二的原子利用率 (填高或低).因此,在实际生产中,应采用工艺 更环保、更经济.下列物质中加入金属钠不产生氢气的是 .
A.乙醇 B.乙酸 C.水 D.苯.
查看习题详情和答案>>
工艺一:

工艺二:
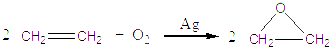
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率
A.乙醇 B.乙酸 C.水 D.苯.
I.根据下列化学方程式回答问题:
SiO2+2C+2Cl
SiCl4+2CO
(1)12gC参与反应时电子转移的数目是
II.请写出下列反应的化学方程式或离子方程式.
(1)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应的离子方程式
(2)利用铝与二氧化锰反应来制取高熔点金属锰的化学方程式
III.某化学兴趣小组拟从海带中提取碘,进行如下实验:干海带
海带灰
浸泡液
I2(CCL4)→I2
从A~C中选择适当的装置填空(填字母):

(1)过滤操作时用到的装置是
(2)从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置
查看习题详情和答案>>
SiO2+2C+2Cl
| ||
(1)12gC参与反应时电子转移的数目是
2NA
2NA
.(2)在该反应中,氧化剂是Cl2
Cl2
.II.请写出下列反应的化学方程式或离子方程式.
(1)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应的离子方程式
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.(2)利用铝与二氧化锰反应来制取高熔点金属锰的化学方程式
4Al+3MnO2
2Al2O3+3Mn
| ||
4Al+3MnO2
2Al2O3+3Mn
.
| ||
III.某化学兴趣小组拟从海带中提取碘,进行如下实验:干海带
| 灼烧 |
| ||
| 过滤 |
| ||
| 萃取分液 |
从A~C中选择适当的装置填空(填字母):

(1)过滤操作时用到的装置是
C
C
.(2)从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置
A
A
.I.根据下列化学方程式回答问题:
SiO2+2C+2Cl
SiCl4+2CO
(1)12gC参与反应时电子转移的数目是______.(2)在该反应中,氧化剂是______.
II.请写出下列反应的化学方程式或离子方程式.
(1)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应的离子方程式______.
(2)利用铝与二氧化锰反应来制取高熔点金属锰的化学方程式______.
III.某化学兴趣小组拟从海带中提取碘,进行如下实验:干海带
海带灰
浸泡液
I2(CCL4)→I2
从A~C中选择适当的装置填空(填字母):
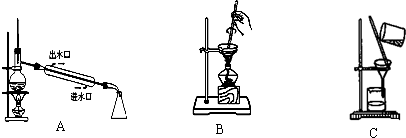
(1)过滤操作时用到的装置是______.
(2)从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置______.
查看习题详情和答案>>
SiO2+2C+2Cl
| ||
(1)12gC参与反应时电子转移的数目是______.(2)在该反应中,氧化剂是______.
II.请写出下列反应的化学方程式或离子方程式.
(1)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应的离子方程式______.
(2)利用铝与二氧化锰反应来制取高熔点金属锰的化学方程式______.
III.某化学兴趣小组拟从海带中提取碘,进行如下实验:干海带
| 灼烧 |
| ||
| 过滤 |
| ||
| 萃取分液 |
从A~C中选择适当的装置填空(填字母):

(1)过滤操作时用到的装置是______.
(2)从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置______.