题目内容
SiO2+2C+2Cl
| ||
(1)12gC参与反应时电子转移的数目是
II.请写出下列反应的化学方程式或离子方程式.
(1)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应的离子方程式
(2)利用铝与二氧化锰反应来制取高熔点金属锰的化学方程式
| ||
| ||
III.某化学兴趣小组拟从海带中提取碘,进行如下实验:干海带
| 灼烧 |
| ||
| 过滤 |
| ||
| 萃取分液 |
从A~C中选择适当的装置填空(填字母):

(1)过滤操作时用到的装置是
(2)从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置
II.(1)铜与氯化铁溶液反应生成2FeCl2和CuCl2;
(2)根据铝热法冶炼金属的原理:金属氧化物与铝反应得到金属和氧化铝.
III.(1).图中有烧杯、漏斗、玻璃棒、铁架台,是过滤的仪器;
(2)根据E装置是蒸馏装置.
II.(1)铜与氯化铁溶液反应生成2FeCl2和CuCl2,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)根据铝热法冶炼金属的原理:金属氧化物与铝反应得到金属和氧化铝,所以铝和MnO2反应的化学方程式为4Al+3MnO2
| ||
故答案为:4Al+3MnO2
| ||
III.(1)根据图形判断,C是过滤实验装置实验,故答案为:C;
(2)因CCl4易挥发,可用蒸馏的方法分离出CCl4,故答案为:A.

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
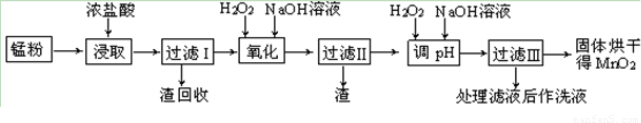
根据上图所示步骤并参考表格数据,回答下列问题。
物 质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程方程式:?????????????????????????????????????????????????????? _。
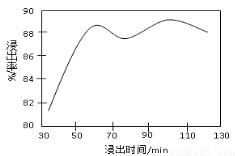
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60 min,其可能原因是???????????????????????????????????????????????????? 。
(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是????????????????????????????????? 。
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是?????????????????????????????????????????????? 。
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+ 氧化得到MnO2,反应的离于方程式为????????????????????????????????????????????????????? 。
(6)工业上利用KOH和MnO2为原料制取KMnO4。主要生产过程分两步进行:第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4。
① 第一步反应的化学方程式为???????????????????????????????????????????????????????????? 。
② 电解K2MnO4的浓溶液时,电解池中阴极的实验现象为???????????????????????????????????????? 。
 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,则选择的试剂为______.
已知:NH3?H2O的电离方程式为:NH3?H2O?NH+4+OH-,试写出NH3溶于水后,形成的NH3?H2O的合理结构______
(4)制备Cl2需用8mol?L-1的盐酸100mL,现用12mol?L-1的盐酸来配制.
①需要12mol?L-1的盐酸的体积为______mL(精确到0.1mL)
②在容量瓶的使用方法中,下列操作不正确的是______(填写标号).
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次
II、(1)常温下,已知0.1mol?L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8.
写出该酸HA与NaOH溶液反应的离子方程式式:______;
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,
则该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=______.
 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容: