摘要:(一)制碱:CaCO3 CaO+CO2↑.CaO+H2O=Ca(OH)2.
网址:http://m.1010jiajiao.com/timu_id_4448855[举报]
工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.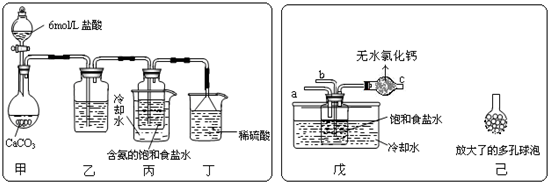
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:
查看习题详情和答案>>
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
| ||
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
c
c
(填字母标号).a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.

①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
,其作用是除去CO2中的HCl气体
除去CO2中的HCl气体
;(Ⅱ)丁装置中稀硫酸的作用是
吸收未反应完的NH3
吸收未反应完的NH3
;(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
过滤
过滤
(填分离操作的名称),该操作所需要的玻璃仪器有玻璃棒、漏斗、烧杯
玻璃棒、漏斗、烧杯
.②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入
氨气
氨气
气体,说明原因氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵
氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵
.(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
增大气体与溶液接触面积,提高CO2的吸收率
增大气体与溶液接触面积,提高CO2的吸收率
.(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为
86.3%
86.3%
.(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:
用碳酸氢铵与适量饱和食盐水反应
用碳酸氢铵与适量饱和食盐水反应
.
纯碱是一种重要的化工原料.制碱工业主要有“氨碱法”(索尔维法)和“联合制碱法”(侯氏制碱法)两种工艺.请按要求回答问题:
(1)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,“氨碱法”中CO2来源于 .
(2)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) .
(3)写出“联合制碱法”有关反应的化学方程式: .
查看习题详情和答案>>
(1)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于
(2)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)
(3)写出“联合制碱法”有关反应的化学方程式:
工业上以NaCl、NH3、CO2等为原料,先制得NaHCO3,进而生产出纯碱.有关化学反应为:NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O.
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号).
a.NaHCO3难溶于水 b.NaHCO3受热易分解
c.NaHCO3的溶解度相对较小,所以在溶液中首先结晶析出
d.NaHCO3的稳定性大于Na2CO3
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
甲位同学将CO2气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).试回答有关问题:
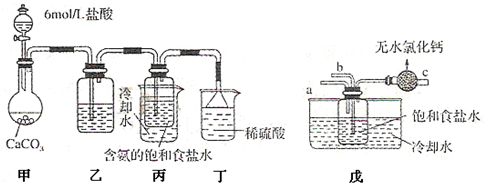
①乙装置的试剂是 ;
②丁装置中稀硫酸的作用是 ;
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称),该操作需要的玻璃仪器有 .乙位同学用图戊装置(其他装置未画出)进行实验.
④实验时,须先从a管通入 (填写化学式),说明原因 .
(3)请你再设计一种实验室制取少量NaHCO3的方法(用化学方程式表示): .
查看习题详情和答案>>
| ||
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.NaHCO3难溶于水 b.NaHCO3受热易分解
c.NaHCO3的溶解度相对较小,所以在溶液中首先结晶析出
d.NaHCO3的稳定性大于Na2CO3
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
甲位同学将CO2气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).试回答有关问题:

①乙装置的试剂是
②丁装置中稀硫酸的作用是
③实验结束后,分离出NaHCO3晶体的操作是
④实验时,须先从a管通入
(3)请你再设计一种实验室制取少量NaHCO3的方法(用化学方程式表示):
(2010?海南模拟)工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①图中X、Y分别是
②分别写出燃料电池B中正极、负极上发生的电极反应正极:
③这样设计的主要节(电)能之处在于(写出2处)
查看习题详情和答案>>
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许
Na+
Na+
(填离子符号,下同)通过,而不允许Cl-、OH-
Cl-、OH-
和气体通过.电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3 ③BaCl2④盐酸,这四种试剂的添加顺序为③②①④或①③②④
③②①④或①③②④
(填序号).氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①图中X、Y分别是
Cl2
Cl2
、H2
H2
(填化学式),分析比较图示中氢氧化钠质量分数 a%与b%的大小a%小于b%
a%小于b%
;②分别写出燃料电池B中正极、负极上发生的电极反应正极:
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
; 负极:H2-2e-+2OH-=2H2O
H2-2e-+2OH-=2H2O
;③这样设计的主要节(电)能之处在于(写出2处)
燃料电池可以补充电解池消耗的电能
燃料电池可以补充电解池消耗的电能
、提高产出碱液的浓度(降低能耗)
提高产出碱液的浓度(降低能耗)
.(2009?广东模拟)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
查看习题详情和答案>>
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3
| ||
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
C
C
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
;(Ⅱ)丁装置中稀硫酸的作用是
吸收未反应的NH3
吸收未反应的NH3
;(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
过滤
过滤
(填分离操作的名称).②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
a
a
管通入NH3
NH3
气体,再从b
b
管中通入CO2
CO2
气体;(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
增大气体与溶液接触面积,提高CO2吸收率
增大气体与溶液接触面积,提高CO2吸收率
;(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
用碳酸氢铵与适量饱和食盐水反应或往烧碱溶液中通入过量CO2;或往饱和Na2CO3溶液中通入过量CO2等
用碳酸氢铵与适量饱和食盐水反应或往烧碱溶液中通入过量CO2;或往饱和Na2CO3溶液中通入过量CO2等
.