��Ŀ����
��ҵ��NaCl��NH3��CO2��Ϊԭ�����Ƶ�NaHCO3����������������йط�Ӧ�Ļ�ѧ����ʽΪ��NH3+CO2+H2O=NH4HCO3��
NH4HCO3+NaCl=NaHCO3��+NH4Cl��2NaHCO3
Na2CO3+CO2��+H2O
��1��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ����
a��̼������������ˮ b��̼�����������ֽ�
c��̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
d��̼�����Ƶ��ȶ��Դ���̼����
��2��ij�С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飮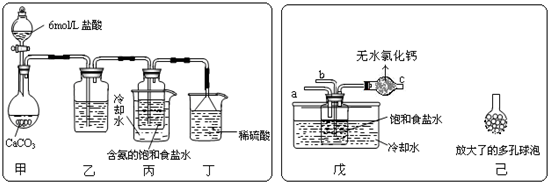
��һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ������ͼ��ʾ��ͼ�мг֡��̶��õ�����δ��������
�Իش������й����⣺
������װ���е��Լ���
����װ����ϡ�����������
����ʵ����������NaHCO3 ����IJ�����
����һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ�飮
����ʵ��ʱ�����ȴ�a��ͨ��
������ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã�������
��3��̼�������������ù���12.28g��������ʯ��ˮ��ַ�Ӧ�����ó�����ϴ�ӡ���������Ϊ12.00g�������ù�����̼���Ƶ���������Ϊ
��4����������Ƴ�һ��ʵ������ȡ����̼�����Ƶķ�����
NH4HCO3+NaCl=NaHCO3��+NH4Cl��2NaHCO3
| ||
��1��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ����
c
c
������ĸ��ţ���a��̼������������ˮ b��̼�����������ֽ�
c��̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
d��̼�����Ƶ��ȶ��Դ���̼����
��2��ij�С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飮

��һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ������ͼ��ʾ��ͼ�мг֡��̶��õ�����δ��������
�Իش������й����⣺
������װ���е��Լ���
����̼��������Һ
����̼��������Һ
������������ȥCO2�е�HCl����
��ȥCO2�е�HCl����
������װ����ϡ�����������
����δ��Ӧ���NH3
����δ��Ӧ���NH3
������ʵ����������NaHCO3 ����IJ�����
����
����
���������������ƣ����ò�������Ҫ�IJ�����������������©�����ձ�
��������©�����ձ�
������һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ�飮
����ʵ��ʱ�����ȴ�a��ͨ��
����
����
���壬˵��ԭ�����������ܽ���ˮ�����γɽϴ�Ũ�ȵ���Һ�������ڶ�����̼���գ����ɸ����̼�����
���������ܽ���ˮ�����γɽϴ�Ũ�ȵ���Һ�������ڶ�����̼���գ����ɸ����̼�����
��������ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã�������
������������Һ�Ӵ���������CO2��������
������������Һ�Ӵ���������CO2��������
����3��̼�������������ù���12.28g��������ʯ��ˮ��ַ�Ӧ�����ó�����ϴ�ӡ���������Ϊ12.00g�������ù�����̼���Ƶ���������Ϊ
86.3%
86.3%
����4����������Ƴ�һ��ʵ������ȡ����̼�����Ƶķ�����
��̼���������������ʳ��ˮ��Ӧ
��̼���������������ʳ��ˮ��Ӧ
����������1������̼�������ܽ����Խ�С�����жϣ�
��2���٣�I��������ȡ������̼ʱ���Ậ���Ȼ�������������ɣ�
��II������ϡ�������백����Ӧ�������
��III�����ݷ��������Һ����õ�ʵ������������
�ڣ�I������ȡ̼������ʱ��Ҫ�õ������ı���ʳ��ˮ���Լ�����������ˮ�����жϣ�
��II����װ�øĶ���Ӧ��ĽӴ�����������жϣ�
��3�����ݻ�ѧ����ʽ��Ϸ�Ӧ���̷����жϣ��������ɳ���Ϊ̼��ƣ�����̼�����Ʒֽ��Ļ���������з��̼��㣻
��4���������Ϣ�Լ���ѧ����ȡ̼�����Ƶ�֪ʶ������ɣ�
��2���٣�I��������ȡ������̼ʱ���Ậ���Ȼ�������������ɣ�
��II������ϡ�������백����Ӧ�������
��III�����ݷ��������Һ����õ�ʵ������������
�ڣ�I������ȡ̼������ʱ��Ҫ�õ������ı���ʳ��ˮ���Լ�����������ˮ�����жϣ�
��II����װ�øĶ���Ӧ��ĽӴ�����������жϣ�
��3�����ݻ�ѧ����ʽ��Ϸ�Ӧ���̷����жϣ��������ɳ���Ϊ̼��ƣ�����̼�����Ʒֽ��Ļ���������з��̼��㣻
��4���������Ϣ�Լ���ѧ����ȡ̼�����Ƶ�֪ʶ������ɣ�
����⣺��1��a��̼������������ˮ����a�����ϣ�
b��̼�����Ƶ����ȷֽ���������أ���b�����ϣ�
c��̼�����Ƶ��ȶ��Բ���̼���ƣ����ڶ����Ȼ����˵̼�����Ƶ��ܽ�ȸ�СһЩ������Ӧ����������
d��̼�����Ƶ��ȶ���С��̼���ƣ���d�����ϣ�
�ʴ�Ϊ��c��
��2���٣�I������������ȡ������̼ʱ������̼�г��Ậ���Ȼ������壬̼�������������ᷴӦ������ͨ������̼�����Ƶ���Һ��Ϊ�˳��������е��Ȼ������壬
�ʴ�Ϊ������̼�����Ƶ���Һ����ȥCO2�е�HCl���壻
��II��ʵ������а���������ʣ�࣬��ϡ�������백����Ӧ������ϡ���������������ĩ��Ӧ��NH3���ʴ�Ϊ������δ��Ӧ���NH3��
��III�������NaHCO3����IJ����Ƿ��������Һ�壬�����õ�ʵ������ǹ��˲������ò�������Ҫ�IJ�������Ϊ����������©�����ձ����ʴ�Ϊ�����ˣ���������©�����ձ���
�ڣ�I����ȡ̼������ʱ��Ҫ�õ������ı���ʳ��ˮ������Ӧ��ͨ�백������������������ˮ������a��ͨ�룬�Ӷ���֤�˴�bͨ�������̼ʱ��֤�˶�����̼�ij�ַ�Ӧ�����������ܽ���ˮ�����γɽϴ�Ũ�ȵ���Һ�������ڶ�����̼���գ����ɸ����̼����泥�
�ʴ�Ϊ�����������������ܽ���ˮ�����γɽϴ�Ũ�ȵ���Һ�������ڶ�����̼���գ����ɸ����̼����泥�
��II��װ�øĶ���Ӧ��Ķ�����̼����Һ�ĽӴ�����������˶�����̼�������ʣ�
�ʴ�Ϊ��������������Һ�Ӵ���������CO2�������ʣ�
��3��̼�������������ù���12.28g��������ʯ��ˮ��ַ�Ӧ�����ó�����ϴ�ӡ���������Ϊ12.00g�������ù�����̼���Ƶ����������������ݻ�ѧ����ʽ���м���õ���
�����ķ�ӦΪ��2NaHCO3=Na2CO3+CO2��+H2O��
NaHCO3+Ca��OH��2=CaCO3��+H2O+NaOH��Na2CO3+Ca��OH��2=CaCO3��+2NaOH����Ӧ���ɵ�̼������ʵ���=
=0.12mol��
����Ⱥ�Ĺ���12��28g�к�̼�������ʵ���x��̼���������ʵ���Ϊy����������õ���
x+y=0.12
106x+84y=12.28
�õ�x=0.1mol��y=0.02mol��
�����ù�����̼���Ƶ���������=
��100%=86.3%��
�ʴ�Ϊ��86.3%��
��4���������ϢNH4HCO3+NaCl�TNaHCO3��+NH4Cl���ɵ���ȡ̼�����Ƶķ�����ͬʱҲ�ɲ����ռ���Һ��ͨ�����CO2��������Na2CO3 ��Һ��ͨ�����CO2 �ȵõ�̼�����ƣ�
�ʴ�Ϊ����̼���������������ʳ��ˮ��Ӧ�������ռ���Һ��ͨ�����CO2��������Na2CO3��Һ��ͨ�����CO2�ȣ���
b��̼�����Ƶ����ȷֽ���������أ���b�����ϣ�
c��̼�����Ƶ��ȶ��Բ���̼���ƣ����ڶ����Ȼ����˵̼�����Ƶ��ܽ�ȸ�СһЩ������Ӧ����������
d��̼�����Ƶ��ȶ���С��̼���ƣ���d�����ϣ�
�ʴ�Ϊ��c��
��2���٣�I������������ȡ������̼ʱ������̼�г��Ậ���Ȼ������壬̼�������������ᷴӦ������ͨ������̼�����Ƶ���Һ��Ϊ�˳��������е��Ȼ������壬
�ʴ�Ϊ������̼�����Ƶ���Һ����ȥCO2�е�HCl���壻
��II��ʵ������а���������ʣ�࣬��ϡ�������백����Ӧ������ϡ���������������ĩ��Ӧ��NH3���ʴ�Ϊ������δ��Ӧ���NH3��
��III�������NaHCO3����IJ����Ƿ��������Һ�壬�����õ�ʵ������ǹ��˲������ò�������Ҫ�IJ�������Ϊ����������©�����ձ����ʴ�Ϊ�����ˣ���������©�����ձ���
�ڣ�I����ȡ̼������ʱ��Ҫ�õ������ı���ʳ��ˮ������Ӧ��ͨ�백������������������ˮ������a��ͨ�룬�Ӷ���֤�˴�bͨ�������̼ʱ��֤�˶�����̼�ij�ַ�Ӧ�����������ܽ���ˮ�����γɽϴ�Ũ�ȵ���Һ�������ڶ�����̼���գ����ɸ����̼����泥�
�ʴ�Ϊ�����������������ܽ���ˮ�����γɽϴ�Ũ�ȵ���Һ�������ڶ�����̼���գ����ɸ����̼����泥�
��II��װ�øĶ���Ӧ��Ķ�����̼����Һ�ĽӴ�����������˶�����̼�������ʣ�
�ʴ�Ϊ��������������Һ�Ӵ���������CO2�������ʣ�
��3��̼�������������ù���12.28g��������ʯ��ˮ��ַ�Ӧ�����ó�����ϴ�ӡ���������Ϊ12.00g�������ù�����̼���Ƶ����������������ݻ�ѧ����ʽ���м���õ���
�����ķ�ӦΪ��2NaHCO3=Na2CO3+CO2��+H2O��
NaHCO3+Ca��OH��2=CaCO3��+H2O+NaOH��Na2CO3+Ca��OH��2=CaCO3��+2NaOH����Ӧ���ɵ�̼������ʵ���=
| 12g |
| 100g/mol |
����Ⱥ�Ĺ���12��28g�к�̼�������ʵ���x��̼���������ʵ���Ϊy����������õ���
x+y=0.12
106x+84y=12.28
�õ�x=0.1mol��y=0.02mol��
�����ù�����̼���Ƶ���������=
| 0.1mol��106g/mol |
| 12.28g |
�ʴ�Ϊ��86.3%��
��4���������ϢNH4HCO3+NaCl�TNaHCO3��+NH4Cl���ɵ���ȡ̼�����Ƶķ�����ͬʱҲ�ɲ����ռ���Һ��ͨ�����CO2��������Na2CO3 ��Һ��ͨ�����CO2 �ȵõ�̼�����ƣ�
�ʴ�Ϊ����̼���������������ʳ��ˮ��Ӧ�������ռ���Һ��ͨ�����CO2��������Na2CO3��Һ��ͨ�����CO2�ȣ���
���������⿼���˹�ҵ�ƴ�������̺�ԭ����������һ��ʵ��̽���ۺ��⣬��ֵ�չʾ�˻�ѧ֪ʶ�ķ������棬�����ۺ���ǿ�ѶȽϴ�ѵ��ѧ�����õ�˼άƷ���Լ�֪ʶ���������нϺõİ�����

��ϰ��ϵ�д�
�����Ŀ

 ��2�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
��2�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�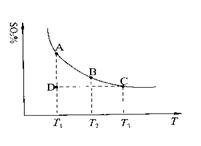
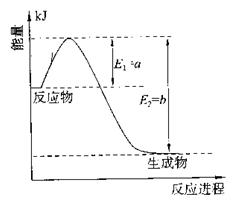

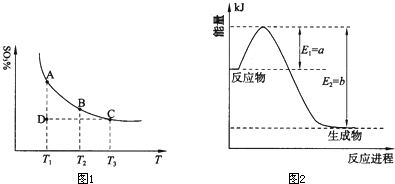
 �����ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
�����ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺

 �ġ�H��������0���>��
�ġ�H��������0���>�� 

 ��
��