网址:http://m.1010jiajiao.com/timu_id_4437[举报]
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)
1.B 2.C 3.B 4.A 5.D 6.A
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
7.AD 8.D 9.B 10.AC 11.BD 12.C 13.D 14.A 15.BC
三.(本题包括2小题,共22分)
16.⑴cd ⑵①硫酸溶液、氢氧化钾溶液 ②1┱4
(除第⑴小题4分外,其余每空2分,共8分)
17.⑴①溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
②同时加入少量碘化钾固体,用适量水使之完全溶解 将第一步所得溶液全部转入1000mL的容量瓶中,定容,摇匀
⑵①800 ②抽气速度过快,或装置气密性较差
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶④ (每空2分,共14分)
四.(本题包括3小题,共30分)
18.⑴第三周期、ⅠA族 ⑵①C+4HNO3(浓)CO2↑+4NO2↑+2H2O
②2Na2O2+2CO2=2Na2CO3+O2 ⑶ (每空2分,共8分)
19.⑴①该晶体是分子晶体,各分子间存在较弱的分子间作用力,故“可燃冰”熔沸点较低
②890.3 kJ?mol-1
⑵①O2+4e=2 O2? 向负极移动 ②固体碳(或炭粒)
⑶寻找新能源,提高燃料的燃烧效率等
(每空2分,共12分)
20.⑴H2O2 ⑵acdefgj 合成塔 ⑥ ⑶Fe4S5+8O22Fe2O3+5SO2
(除第⑵小题第2、3空1分外,其余每空2分,共10分)
五.(本题包括2小题,共20分)
21.⑴乙基 C9H12O3 ⑵与NaOH溶液在加热条件下反应
⑶ (每空2分,共8分)
22.⑴加成反应 ⑵⑥ 保护B(或G)分子中的C=C不被氧化
⑶
⑷ HOOCCH2CHClCOOH+3NaOHNaOOCCH=CHCOONa+NaCl+3H2O
2CH3CH2CH2CH2OH+HOOCCH=CHCOOH
CH3(CH2)3OOCCH=CHCOO(CH2)3CH3+2H2O (每空2分,共12分)
六.(本题包括2小题,共18分)
23.⑴CaCO3?MgCO3 (4分)
⑵由于炭粉过量,则白云石分解后的产物与炭粉反应完全,据氧元素守恒知,CaCO3?MgCO3→6CO,则V ==0.73am (4分)
24.⑴设乙烯总量为1mol,第①步反应消耗乙烯为xmol,则第②步产生的CH3COOH为x?75%×80%=0.6x。
由反应③知:=
即:x= 1-x=
故两次投料比为=x:(1-x)=5:3。 (4分)
⑵n(CH2=CH2)==1×106mol
m(CH3COOCH=CH2)=1×106mol××75%×86g/mol=2.42×107g=2.42×104kg(3分)
⑶ 第①步消耗氧气:n(O2)1=n(CH2=CH2)××=n(CH2=CH2)
第②步消耗氧气:n(O2)2=n(CH2=CH2)××75%×=n(CH2=CH2)
第③消耗氧气:n(O2)3=n(CH2=CH2)×=n(CH2=CH2)
n(O2)总=n(CH2=CH2)+n(CH2=CH2)+n(CH2=CH2)=n(CH2=CH2)
n(空气)=5×n(CH2=CH2)=n(CH2=CH2)
故:= (3分)
注:答题中出现的其它合理答案均给分
(6分)下列实验设计或操作合理的是 。
a.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
b.只用水就能鉴别苯、硝基苯、乙醇;
c.实验室通过浓硫酸与乙醇反应制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度;
d.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子;
e.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液的温度;
f.将1-溴丙烷与浓硫酸反应用酸性KMnO4溶液直接检验是否得到乙烯。
查看习题详情和答案>>a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8 mL的Na2CO3溶液
d.实验室酸制氯化亚锡溶液时,可以先将氯化亚锡溶解在盐酸中,再配制到所需要的浓度
e.使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤干净
f.在用稀硫酸和锌粒反应制取氢气时加入少许硫酸铜以加快化学反应速率
II.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计如图所示实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题。

___________。
(3)图中①.②.③.④装置可盛放的试剂是:①___________;②___________;③___________;
④___________。(将下列有关试剂的序号填入空格内)
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(4)能说明二氧化硫气体存在的现象是______________________
(5)使用装置②的目的是_________________________________
(6)使用装置③的目的是_________________________________
(7)确定含有乙烯的现象是_______________________________
(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
A.FeCl3 B.FeCl2 C.CuCl2 D.FeS
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用: 。开始加热前 (填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和
NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为_________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②
查看习题详情和答案>>
(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
A.FeCl3B.FeCl2 C.CuCl2D.FeS
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用: 。开始加热前 (填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和
NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②
查看习题详情和答案>>
(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题: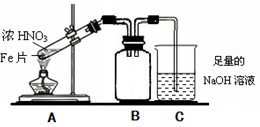
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ② 查看习题详情和答案>>