摘要:(二)教师准备 5. 将学生每四人编为一组, 6. 编制“活动·探究 活动报告及评价表, 7. 针对学生设计的活动探究方案配合实验老师准备实验器材与药品.
网址:http://m.1010jiajiao.com/timu_id_4435005[举报]
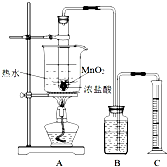 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.方法一:
甲同学利用图装置,测定盐酸浓度降至临界浓度时 反应生成氯气的体积,来探究在某温度下浓盐酸与二氧化锰反应的临界浓度.
方法:A中试管有足量的MnO2,往其中加入10mol/L的浓盐酸,控制温度为80℃进行反应.甲同学进行了三次同样的实验,收集气体(体积均换算成标准状况),数据如下表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
(1)请写出A中试管内反应的离子方程式
(2)检验该装置的气密性的方法是
(3)B中加入的溶液为
(4)为计算与二氧化锰反应的浓盐酸临界浓度,甲同学的第
方法二:
(5)乙同学认为该实验有不足之处:浓盐酸易挥发,会造成上述所测的临界浓度
乙同学提出可直接用反应后A中的溶液来测定盐酸的临界浓度:
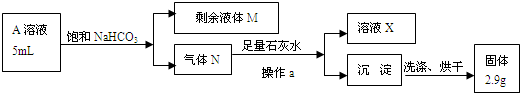
(6)以上图表中操作a的名称是
(7)请写出A溶液中的物质与NaHCO3溶液反应的离子方程式:
(8)根据以上数据,浓盐酸与二氧化锰制氯气的反应中浓盐酸的临界浓度为
(2012?河东区二模)5-氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:
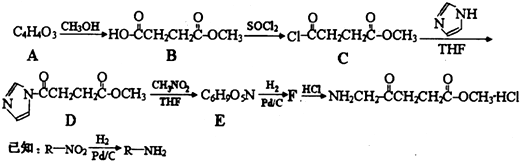
(1)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一个峰,则A的结构简式为
 .
.
(2)5-氨基酮戊酸盐中含氧官能团的名称是
(3)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1mol G与足量金属Na反应能生成1mol H2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式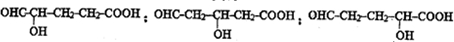
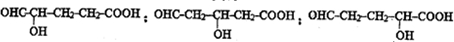 .
.
(4)写出D→E的反应方程式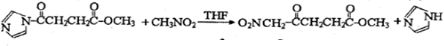
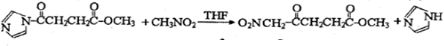
(5)已知:
请结合题中所给信息,写出由CH3CH2COOH、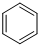 为原料合成
为原料合成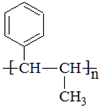 单体的路线流程图(无机试剂任选)
单体的路线流程图(无机试剂任选)
合成流程路线图示例如下CH2=CH2
CH3CH2Br
CH3CH2OH
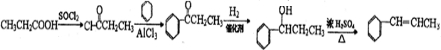
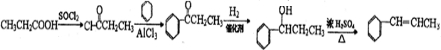 .
.
查看习题详情和答案>>

(1)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一个峰,则A的结构简式为


(2)5-氨基酮戊酸盐中含氧官能团的名称是
羰基、酯基
羰基、酯基
;C→D的反应类型为取代
取代
反应.(3)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1mol G与足量金属Na反应能生成1mol H2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式
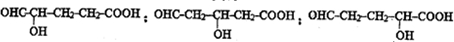
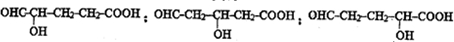
(4)写出D→E的反应方程式
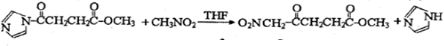
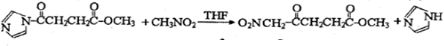
(5)已知:
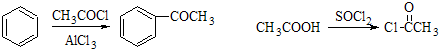
请结合题中所给信息,写出由CH3CH2COOH、
 为原料合成
为原料合成 单体的路线流程图(无机试剂任选)
单体的路线流程图(无机试剂任选)合成流程路线图示例如下CH2=CH2
| HBr |
| NaOH溶液 |
| △ |
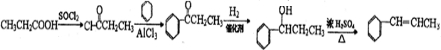
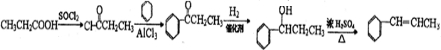
(2009?广东)警察常从案发现场的人体气味来获取有用线索,人体气味的成分中含有以下化合物:①辛酸;②壬酸;③环十二醇;④5,9一十一烷酸内酯;⑤十八烷⑥己醛;⑦庚醛.下列说法正确的是( )
查看习题详情和答案>>
Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视.
(1)工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g).实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
③该反应的平衡常数K为
④500℃达平衡时,CH3OH的体积分数ω为
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2 (g)+CO(g)?CH3OH (g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2 (g)+H2(g)△H=-41.3kJ?mol-1
(3)总合成反应的热化学方程式为
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
此时,v (正)
查看习题详情和答案>>
(1)工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g).实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.

①从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225mol/(L?min)
0.225mol/(L?min)
;②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
放
放
热(填“吸”或“放”)反应.③该反应的平衡常数K为
5.33
5.33
(保留两位小数).若提高温度到800℃进行,达平衡时,K值减小
减小
(填“增大”、“减小”或“不变”),④500℃达平衡时,CH3OH的体积分数ω为
0.3
0.3
.(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为
2CO2+4e-+2H2O=2CO+4OH-
2CO2+4e-+2H2O=2CO+4OH-
.Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2 (g)+CO(g)?CH3OH (g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2 (g)+H2(g)△H=-41.3kJ?mol-1
(3)总合成反应的热化学方程式为
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol
.(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是
CE
CE
(填字母代号).A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol?L-1 | 0.44 | 0.60 | 0.60 |
>
>
v (逆) (填“>”、“<”或“=”).现有四组分散系:①汽油和水形成的乳浊液 ②含有泥沙的食盐水 ③溶有碘(I2)的碘化钾溶液 ④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表).
 |
查看习题详情和答案>>