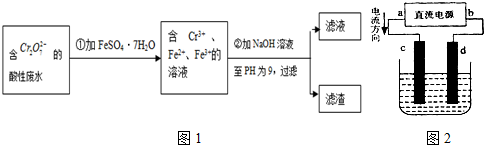
题目内容
(1)K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O (用“单线桥”表示电子转移的方向和数目)氧化剂是(2)
(3)配平下列氧化还原反应方程式:
(4)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为
分析:(1)根据方程式确定转移电子数目,单线桥由提供电子的物质(元素)指向得电子的物质(元素);
所含元素化合价降低反应物是氧化剂;根据化合价变化可知,CrCl3是还原产物、Cl2是氧化产物,根据方程式判断氧化产物与还原产物的物质的量之比;
(2)根据n=
计算9.03×1022个原子的物质的量,结合1个水分子含有原子数目计算水的物质的量,根据m=nM计算水的质量;
(3)反应中KMnO4→MnSO4,Mn元素化合价由+7降低为+2,共降低5价,H2S→S,S元素化合价由-2价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,H2S的系数为5,再根据原子守恒配平其它物质的系数;
(4)被氧化的氨气生成氮气,根据方程式计算生成氨气的物质的量,再根据氮原子守恒计算被氧化的氨气的物质的量,根据V=nVm计算被氧化氨气的体积.
所含元素化合价降低反应物是氧化剂;根据化合价变化可知,CrCl3是还原产物、Cl2是氧化产物,根据方程式判断氧化产物与还原产物的物质的量之比;
(2)根据n=
| N |
| NA |
(3)反应中KMnO4→MnSO4,Mn元素化合价由+7降低为+2,共降低5价,H2S→S,S元素化合价由-2价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,H2S的系数为5,再根据原子守恒配平其它物质的系数;
(4)被氧化的氨气生成氮气,根据方程式计算生成氨气的物质的量,再根据氮原子守恒计算被氧化的氨气的物质的量,根据V=nVm计算被氧化氨气的体积.
解答:解:(1)反应中Cr元素化合价降低,元素化合价由+6价降低为+3价,共注意电子数为6e-,用单线桥法标出电子转移的方向和数目可表示为 ,K2Cr2O7所含的Cr元素化合价降低,K2Cr2O7为氧化剂,根据化合价变化可知,CrCl3是还原产物、Cl2是氧化产物,根据方程式可知氧化产物与还原产物的物质的量之比为3:2,
,K2Cr2O7所含的Cr元素化合价降低,K2Cr2O7为氧化剂,根据化合价变化可知,CrCl3是还原产物、Cl2是氧化产物,根据方程式可知氧化产物与还原产物的物质的量之比为3:2,
故答案为: ;K2Cr2O7;3:2;
;K2Cr2O7;3:2;
(2)9.03×1022个原子的物质的量为
=0.15mol,1个水分子含有3个原子,故水的物质的量为
=0.05mol,故水的质量为0.05mol×18g/mol=0.9g,
故答案为:0.05;0.9g;
(3)反应中KMnO4→MnSO4,Mn元素化合价由+7降低为+2,共降低5价,H2S→S,S元素化合价由-2价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,H2S的系数为5,再根据原子守恒配平其它物质的系数,配平后方程式为:2KMnO4+5H2S+3H2SO4(稀)=2MnSO4+5S↓+1K2SO4+8H2O,
故答案为:2、5、3、2、5、1、8;
(4)被氧化的氨气生成氮气,根据方程式可知生成氨气的物质的量为1.5mol×
=0.5mol,根据氮原子守恒可知被氧化的氨气的物质的量为0.5mol×2=1mol,故被氧化氨气的体积为1mol×22.4L/mol=22.4L,
故答案为:22.4.
 ,K2Cr2O7所含的Cr元素化合价降低,K2Cr2O7为氧化剂,根据化合价变化可知,CrCl3是还原产物、Cl2是氧化产物,根据方程式可知氧化产物与还原产物的物质的量之比为3:2,
,K2Cr2O7所含的Cr元素化合价降低,K2Cr2O7为氧化剂,根据化合价变化可知,CrCl3是还原产物、Cl2是氧化产物,根据方程式可知氧化产物与还原产物的物质的量之比为3:2,故答案为:
 ;K2Cr2O7;3:2;
;K2Cr2O7;3:2;(2)9.03×1022个原子的物质的量为
| 9.03×1022 |
| 6.02×1023mol-1 |
| 0.15mol |
| 3 |
故答案为:0.05;0.9g;
(3)反应中KMnO4→MnSO4,Mn元素化合价由+7降低为+2,共降低5价,H2S→S,S元素化合价由-2价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,H2S的系数为5,再根据原子守恒配平其它物质的系数,配平后方程式为:2KMnO4+5H2S+3H2SO4(稀)=2MnSO4+5S↓+1K2SO4+8H2O,
故答案为:2、5、3、2、5、1、8;
(4)被氧化的氨气生成氮气,根据方程式可知生成氨气的物质的量为1.5mol×
| 1 |
| 3 |
故答案为:22.4.
点评:本题考查氧化还原反应基本概念、配平、计算与电子转移表示方法等,题目难度不大,注意从元素化合价的角度判断氧化还原反应的相关概念,注意能熟练用单线桥法标出电子转移的方向和数目.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
 2CrO42-+2H+
2CrO42-+2H+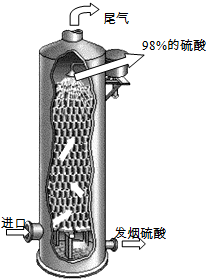 (2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.