题目内容
(1)2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O 氧化剂是
(2)MnO2+4HCl═MnCl2+2H2O+Cl2↑ MnO2被
(3)6KOH+3Cl2=5KCl+KClO3+3H2O,请用双线桥表示电子的转移,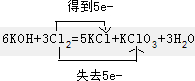
 .
.
Cl2
Cl2
还原剂是Cl2
Cl2
(2)MnO2+4HCl═MnCl2+2H2O+Cl2↑ MnO2被
还原
还原
HCl被氧化
氧化
(填“氧化”或“还原”)(3)6KOH+3Cl2=5KCl+KClO3+3H2O,请用双线桥表示电子的转移,


分析:(1)Cl元素的化合价既升高又降低;
(2)Mn元素的化合价降低,Cl元素的化合价升高;
(3)Cl元素的化合价既升高又降低,反应中转移5e-.
(2)Mn元素的化合价降低,Cl元素的化合价升高;
(3)Cl元素的化合价既升高又降低,反应中转移5e-.
解答:解:(1)Cl元素的化合价既升高又降低,则Cl2既是氧化剂又是还原剂,故答案为:Cl2;Cl2;
(2)Mn元素的化合价降低,Cl元素的化合价升高,则MnO2被还原,HCl被氧化,故答案为:还原;氧化;
(3)Cl元素的化合价既升高又降低,反应中转移5e-,双线桥表示电子的转移为 ,
,
故答案为: .
.
(2)Mn元素的化合价降低,Cl元素的化合价升高,则MnO2被还原,HCl被氧化,故答案为:还原;氧化;
(3)Cl元素的化合价既升高又降低,反应中转移5e-,双线桥表示电子的转移为
 ,
,故答案为:
 .
.点评:本题考查氧化还原反应,侧重基本概念及转移电子的考查,明确反应中元素的化合价即可解答,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目


 TiCl4+2CO
TiCl4+2CO