题目内容
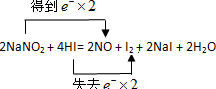
经常有人因误食亚硝酸钠(NaNO2)而中毒,原因是NaNO2像食盐一样既有咸味,又有很强毒性.已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O.
(1)在此反应中,氧化剂是
(2)用双线桥表示电子转移的情况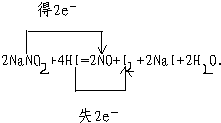
 .
.
(3)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为
(1)在此反应中,氧化剂是
NaNO2
NaNO2
(填化学式),氧化产物是I2
I2
(填化学式).(2)用双线桥表示电子转移的情况


(3)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为
NA
NA
.分析:(1)根据化合价的变化判断氧化剂、还原剂、氧化产物、还原产物;
(2)根据双线桥的表示方法标出电子转移的情况;
(3)根据还原剂与电子转移的关系计算;
(2)根据双线桥的表示方法标出电子转移的情况;
(3)根据还原剂与电子转移的关系计算;
解答:解:(1)元素化合价的变化分别如下:氮元素:NaNO2 →NO,由+3价→+2价,得电子,所以NaNO2是氧化剂,
NO是还原产物;
碘元素,HI→I2,由-1价→0价,失电子,所以 HI 是还原剂,I2 是氧化产物;
故答案为:NaNO2; I2;
(2)NaNO2是氧化剂,HI 是还原剂,转移电子数为2,
故答案为:
(3)2NaNO2+2HI(作酸)+2HI(作还原剂)=2NO+I2+2NaI+2H2O 电子转移数
2 mol 2NA
1mol NA
故答案为:NA
NO是还原产物;
碘元素,HI→I2,由-1价→0价,失电子,所以 HI 是还原剂,I2 是氧化产物;
故答案为:NaNO2; I2;
(2)NaNO2是氧化剂,HI 是还原剂,转移电子数为2,
故答案为:

(3)2NaNO2+2HI(作酸)+2HI(作还原剂)=2NO+I2+2NaI+2H2O 电子转移数
2 mol 2NA
1mol NA
故答案为:NA
点评:本题考查了有关氧化还原反应的知识,正确分析HI的作用是解(3)题的关键

练习册系列答案
相关题目