摘要:第Ⅳ象限符号为“-.+ 时化学反应的方向--所有温度下反应均不能自发进行 [例4]CO+1/2O2(g).其△H=110.5 kJ·mol-1△S== -89.36J·mol-1·K-1.试判断该反应在298K和2000K时反应是否自发进行? [解析] 298K时.△H-T△S=110.5 kJ·mol-1-298K×10-3×(-89.36kJ·mol-1·K-1) ==137.13 kJ·mol-1>0.故298K时反应不能自发进行. 2000K时.△H-T△S=110.5 kJ·mol-1-2000K×10-3×(-89.36kJ·mol-1·K-1) ==289.22 kJ·mol-1>0.故2000K时.反应也不能自发进行. 事实上.△S<0.△H>0时.仅从符号上进行分析.无论温度如何变化.恒有△H-T△S>0.故化学反应的方向--所有温度下反应均不能自发进行. 从以上四个象限的情况来看.交叉象限的情况相反相成.第Ⅰ象限和第Ⅲ象限相反相成.第Ⅱ象限(所有温度下均可自发进行)和第Ⅳ象限(所有温度下反应均不能自发进行)相反相成.分析化学反应的方向的热力学判据是△H-T△S<0.而这个判据是温度.压强一定的条件下反应自发进行的趋势.并不能说明反应能否实际发生.因为反应能否实际发生还涉及动力学问题. 基础过关 第3课时 化学反应的限度
网址:http://m.1010jiajiao.com/timu_id_4426262[举报]
 德国重离子研究中心于2010年2月19日宣布,以国际纯粹与应用化学联合会确认,由该中心合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”.选择2月19日为新元素正式冠名日,也是因为这一天是哥白尼的生日,有报道称Cn原子含有165个中子.下列有关112号元素的相关说法正确的是
德国重离子研究中心于2010年2月19日宣布,以国际纯粹与应用化学联合会确认,由该中心合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”.选择2月19日为新元素正式冠名日,也是因为这一天是哥白尼的生日,有报道称Cn原子含有165个中子.下列有关112号元素的相关说法正确的是( )
 (1)在第3周期中,置换酸中氢的能力最强的元素的元素符号为
(1)在第3周期中,置换酸中氢的能力最强的元素的元素符号为Na
Na
,a.化学性质最稳定的元素符号是
Ar
Ar
,b.最高价氧化物的水化物的酸性最强的化合物的化学式是
HClO4
HClO4
,c.碱性最强的化合物的化学式是
NaOH
NaOH
,d.显两性的氧化物的化学式是
Al2O3
Al2O3
,该两性氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
、Al2O3+2OH-=AlO2-+H2O
Al2O3+2OH-=AlO2-+H2O
,e.原子半径最大的金属元素的名称是
钠
钠
,f.离子半径最小的离子结构示意图是
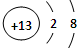
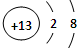
(2)反应A(g)+B(s)
 C(g)在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”“减慢”或“不变”):?a.升温
C(g)在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”“减慢”或“不变”):?a.升温加快
加快
;?b.增大压强加快
加快
;c.增大容器容积减慢
减慢
;?d.加入A加快
加快
;?e.加入B不变
不变
;?f.加正催化剂加快
加快
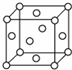
.(3)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)
Ⅰ>Ⅲ>Ⅱ
Ⅰ>Ⅲ>Ⅱ
.2010年2月19日IUPAC(国际纯粹与应用化学联合会)宣布,第112号化学元素正式名称为“Copernicium”,元素符号为“Cn”,以纪念著名天文学家哥白尼,该元素的一种核素含有的中子数为165.下列关于Cn说法不正确的是( )
查看习题详情和答案>>
 (2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
(2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.(1)上述反应的催化剂常用第四周期两种金属元素的化合物,其中一种元素的原子L层电子数与最外层电子数之比为4:1,d轨道中的电子数与最外层电子数之比为5:1,它的元素符号为
Zn
Zn
,其+2价离子的核外电子排布式是1s22s22p63s23p63d10
1s22s22p63s23p63d10
.(2)根据等电子原理,写出CO分子的结构式
C≡O
C≡O
.(3)甲醇催化氧化可得到甲醛.
①甲醇的沸点比甲醛的高,其主要原因是
甲醇分子之间形成氢键
甲醇分子之间形成氢键
;②甲醛分子中碳原子轨道的杂化类型为
sp2杂化
sp2杂化
.甲醛分子的空间构型是平面三角形
平面三角形
; 1mol甲醛分子中σ键的数目为3NA
3NA
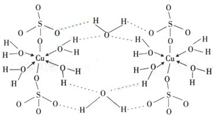
.(4)上述反应的催化剂另一种是铜元素的化合物.已知铜的重要化合物胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如:下列说法正确的是
BD
BD
(填字母).A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去.
(2010?天津)X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.
回答下列问题:
(1)L的元素符号为
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为
 ,B的结构式为
,B的结构式为
 .
.
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
a.+99.7kJ?mol-1 b.+29.7kJ?mol-1 c.-20.6kJ?mol-1 d.-241.8kJ?mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:
查看习题详情和答案>>
回答下列问题:
(1)L的元素符号为
O
O
;M在元素周期表中的位置为第三周期、第ⅢA族
第三周期、第ⅢA族
;五种元素的原子半径从大到小的顺序是Al>C>N>O>H
Al>C>N>O>H
(用元素符号表示).(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为




(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
34
34
,其最高价氧化物对应的水化物化学式为H2SeO4
H2SeO4
.该族2~5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是b
b
(填字母代号).a.+99.7kJ?mol-1 b.+29.7kJ?mol-1 c.-20.6kJ?mol-1 d.-241.8kJ?mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:
Al+3HCO3--3e-=Al(OH)3↓+CO2↑
Al+3HCO3--3e-=Al(OH)3↓+CO2↑
;由R生成Q的化学方程式:2Al(OH)3
Al2O3+2H2O
| ||
2Al(OH)3
Al2O3+2H2O
.
| ||