摘要: 物质变化的反应式 (1) 化学方程式:以分子式表示化学反应的式子. 原则:要遵循客观存在的事实,要遵循质量守恒定律. 含义: ①表示参加反应的反应物与生成物 ②表示参加反应的反应物与生成物的微粒数之比 ③表示反应中反应物与生成物的质量比 ④若各物质为气态时.还表示反应中反应物与生成物的体积比. 注意:I.表明反应所需的条件, II.一般化学反应用“= 表示.若是可逆反应则用“≒ 表示.如水解.弱电质的电离等.若是有机物参加的反应则用“→ 表示. III.化学方程式配平的方法有如下几种: ① 观察法②奇数配偶数法③最小公倍数④氧化还原反应可用化合价升降法 (详见氧化还原方程式的配平).
网址:http://m.1010jiajiao.com/timu_id_4424774[举报]
写出下列反应的化学方程式:
(1)Br2在加热的情况下跟氢氧化钠溶高考资源网液反应生成溴化钠、溴酸钠(NaBrO3)和水,化学方程式为:________.
(2)氯胺(NH2Cl)在中性或酸性条件下是一种强消毒杀菌剂,常用于城市自来水杀毒.根据水解原理你认为主要发生的化学反应方程式为:________.
(3)氯酸是一种强酸,当氯酸溶液中氯酸的质量分数超过40%时,它会迅速分解,产生一种比它酸性更强的酸,同时放出a,b两种气体,其中a能使余烬的木条复燃;b能使润湿的碘化钾试纸变蓝;而且a与b的物质的量之比为15∶8.根据以上事实写出氯酸分解的化学反应方程式:________.
 物质A经如图所示的过程转化为含氧酸D,D为强酸,请回答下列问题:
物质A经如图所示的过程转化为含氧酸D,D为强酸,请回答下列问题:(1)若A在常温下为气体单质则回答:
①A、C的化学式分别是:A
N2
N2
;CNO2
NO2
.②将C通入水溶液中,反应化学方程式为
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(2)若仅A、B在常温下为气体且为化合物,则回答:
①A的化学式是:A
H2S
H2S
.②B生成C的化学方程式为
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
③一定条件下碳单质与D反应的方程式为
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
,该反应中D起到的作用是
| ||
氧化剂作用
氧化剂作用
.(3)若A在常温下为固体单质则回答:
①D的化学式是
H2SO4
H2SO4
;②向含2mol D的浓溶液中加入足量的Cu加热,标准状况下产生的气体体积
小于
小于
22.4L(填“大于”“等于”或“小于”),原因为随反应的进行,硫酸逐渐消耗且生成水,浓硫酸变为稀硫酸不能与铜继续反应,所以硫酸不能反应完全,生成的二氧化硫小于22.4升.
随反应的进行,硫酸逐渐消耗且生成水,浓硫酸变为稀硫酸不能与铜继续反应,所以硫酸不能反应完全,生成的二氧化硫小于22.4升.
.化学学习中,有关物质性质的学习离不开实验,请阅读下列对应的内容,并按要求完成填空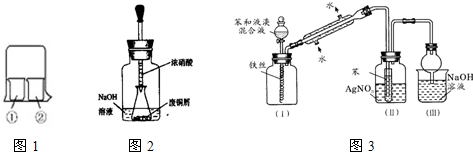
(1)实验室经常用烧杯进行性质实验研究,如用图1所示装置及下表中试剂,过一段时间实验1、2、3、4烧杯①中的现象分别是
(2)用图2装置:废铜屑制硝酸铜,反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有
(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题.
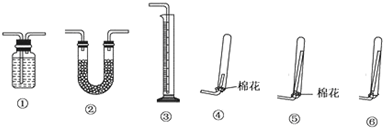
①若要测定生成的NH3的体积,则必须选择的装置是
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1-10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式
(4)图3是苯与溴发生反应并进行产物检验的反应装置实验装置中的冷凝管“左低右高”的放置目的是
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫.
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠.
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠.
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎.
②将研钵中的样品露置在空气中两天.
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡.
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少.
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)
(6)如果要验证③是否成立的实验方法是
查看习题详情和答案>>

(1)实验室经常用烧杯进行性质实验研究,如用图1所示装置及下表中试剂,过一段时间实验1、2、3、4烧杯①中的现象分别是
变蓝
变蓝
,无明显现象
无明显现象
,有白色胶状沉淀
有白色胶状沉淀
,变白
变白
,| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |
NaNO3、NaNO2
NaNO3、NaNO2
(填写化学式)(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题.

①若要测定生成的NH3的体积,则必须选择的装置是
①③
①③
(填装置序号),装置中所盛试剂应具有的性质是氨气难溶于该溶剂,该溶剂不易挥发、不与氨气反应
氨气难溶于该溶剂,该溶剂不易挥发、不与氨气反应
.收集干燥的NH3,收集装置应选择(填装置序号)⑤
⑤
,理由是导管较长,棉花可以防止空气对流,有利于收集到较为干燥纯净的氨气
导管较长,棉花可以防止空气对流,有利于收集到较为干燥纯净的氨气
.②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1-10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式
Ca2++2NH3+CO2+H2O→CaCO3+NH4+
Ca2++2NH3+CO2+H2O→CaCO3+NH4+
.(4)图3是苯与溴发生反应并进行产物检验的反应装置实验装置中的冷凝管“左低右高”的放置目的是
使冷凝回流的反应物苯和液溴回到(Ⅰ)中继续反应
使冷凝回流的反应物苯和液溴回到(Ⅰ)中继续反应
,整套实验装置中能防止倒吸的装置是(Ⅱ)(Ⅲ)
(Ⅱ)(Ⅲ)
(填装置序号)对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫.
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠.
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠.
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎.
②将研钵中的样品露置在空气中两天.
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡.
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少.
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)
2H2S+SO2=2H2O+3S↓
2H2S+SO2=2H2O+3S↓
.(6)如果要验证③是否成立的实验方法是
取少量未知液于试管中,先滴加过量的稀盐酸,无任何现象(无沉淀生成、无气体出现),再滴加氯化钡溶液,出现白色沉淀
取少量未知液于试管中,先滴加过量的稀盐酸,无任何现象(无沉淀生成、无气体出现),再滴加氯化钡溶液,出现白色沉淀
. 化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.
化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.(1)许多化学反应的反应热可以直接测量,测量仪器叫做
量热计
量热计
.(2)下列△H表示物质燃烧热的是
△H4、△H5
△H4、△H5
(填序号);表示中和热的是△H6
△H6
(填“△H1、△H2、或△H3”等).A.2H2(g)+O2(g)═2H2O(l);△H1
B.C(s)+
| 1 |
| 2 |
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3
D.C(s)+O2(g)═CO2(g);△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H5
F.NaOH(ag)+HCl(ag)═NaCl(ag)+H2O(l);△H6
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7
(3)已知15g乙烷完全燃烧生成CO2和液态水,放热a kJ,下列热化学方程式正确是
C
C
.A.C2H6(g)+
| 7 |
| 2 |
B.C2H6(g)+
| 7 |
| 2 |
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4a kJ/mol
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2a kJ/mol
(4)充分燃烧一定丁烷放出热量161.9kJ,生成的CO2恰好与5mol/L 100mL KOH溶液完全反应生成正盐,则燃烧1mol丁烷放出能量为
2590.4kJ
2590.4kJ
.(5)进一步研究表明,化学反应能量变化与键能有关.键能简单理解断开1mol化学键吸收能量.下表是键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能(kJ/mol) | 197 | 360 | 499 | X |
433.75
433.75
.化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放.某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境.
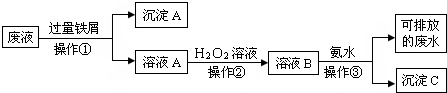
(1)操作①的名称是
(2)操作②反应时还需加入少量硫酸,操作②中观察到的实验现象是
(3)操作②中发生反应的离子方程式为
(4)简述以沉淀A为原料制得金属铜和绿矾晶体(FeSO4?7H2O)的实验方案
查看习题详情和答案>>

(1)操作①的名称是
过滤
过滤
.(2)操作②反应时还需加入少量硫酸,操作②中观察到的实验现象是
溶液由浅绿色变为棕黄色,有少量气泡出现
溶液由浅绿色变为棕黄色,有少量气泡出现
.(3)操作②中发生反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++H2O
2Fe2++H2O2+2H+=2Fe3++H2O
.(4)简述以沉淀A为原料制得金属铜和绿矾晶体(FeSO4?7H2O)的实验方案
在沉淀中加入稀硫酸,搅拌,至不再有气泡产生,过滤,洗涤固体并干燥得铜.滤液加热浓缩后冷却结晶,过滤,干燥得绿矾.
在沉淀中加入稀硫酸,搅拌,至不再有气泡产生,过滤,洗涤固体并干燥得铜.滤液加热浓缩后冷却结晶,过滤,干燥得绿矾.
.