摘要:已知下列热化学方程式: Zn(固)+O2+Q1.Hg(液)+ O2+Q0 则Zn+ZnO A.Q2-Q1 B.Q1+Q2 C.Q1-Q2 D.-(Q1+Q2)
网址:http://m.1010jiajiao.com/timu_id_4424398[举报]
能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l);△H=-570kJ/mol;
②H2(g)+
2O2(g)=H2O(g);△H=-242kJ/mol
③C(s)+
O2(g)=CO(g);△H=-110.5kJ/moL
④C(s)+O2(g)=CO2(g);△H=-393.5kJ/moL
⑤CO2(g)+2H2O(g)=2CH4(g)+2O2(g);△H=+890kJ/moL
回答下列问题:
(1)上述反应中属于吸热反应的是
(2)H2的燃烧热为
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然难直接测定,但可通过间接的方法求得.已知C(s)+H2O(g)=H2(g)+CO (g)△H=akJ/moL;则a=
查看习题详情和答案>>
①2H2(g)+O2(g)=2H2O(l);△H=-570kJ/mol;
②H2(g)+
| 1 |
| 2 |
③C(s)+
| 1 |
| 2 |
④C(s)+O2(g)=CO2(g);△H=-393.5kJ/moL
⑤CO2(g)+2H2O(g)=2CH4(g)+2O2(g);△H=+890kJ/moL
回答下列问题:
(1)上述反应中属于吸热反应的是
⑤
⑤
(2)H2的燃烧热为
285.8kJ?mol-1
285.8kJ?mol-1
.(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然难直接测定,但可通过间接的方法求得.已知C(s)+H2O(g)=H2(g)+CO (g)△H=akJ/moL;则a=
+131.5
+131.5
;该反应的熵△S>
>
0(选填“>”、“=”、“<”).已知下列热化学方程式:
①2H2(g)+O2 (g)=2H2O(l);△H=-570kJ?mol-1
②2H2(g)+O2 (g)=2H2O(g);△H=-483.6kJ?mol-1
③C(s)+
O2 (g)=CO(g);△H=-110.5kJ?mol-1
④C(s)+O2 (g)=CO2(g);△H=-393.5kJ?mol-1
回答下列问题:
(1)H2的燃烧热为
(2)燃烧1gH2生成液态水,放出的热量为
(3)写出CO燃烧的热化学方程式
查看习题详情和答案>>
①2H2(g)+O2 (g)=2H2O(l);△H=-570kJ?mol-1
②2H2(g)+O2 (g)=2H2O(g);△H=-483.6kJ?mol-1
③C(s)+
| 1 |
| 2 |
④C(s)+O2 (g)=CO2(g);△H=-393.5kJ?mol-1
回答下列问题:
(1)H2的燃烧热为
285KJ/mol
285KJ/mol
;(2)燃烧1gH2生成液态水,放出的热量为
142.5KJ
142.5KJ
.(3)写出CO燃烧的热化学方程式
CO(g)+
O2(g)=CO2(g)△H=-283KJ/mol
| 1 |
| 2 |
CO(g)+
O2(g)=CO2(g)△H=-283KJ/mol
.| 1 |
| 2 |
已知下列热化学方程式:
①H2(g)+
O2(g)═H2O(l);△H=-285.8kJ?mol-1
②H2(g)+
O2(g)═H2O(g);△H=-241.8kJ?mol-1
③CO(g)═C(s)+
O2(g);△H=+110.5kJ?mol-1
④C(s)+O2(g)═CO2(g);△H=-393.5kJ?mol-1
回答下列问题:
(1)上述反应中属于放热反应的是
(2)H2的燃烧热△H= .
(3)燃烧10g H2生成液态水,放出的热量为 .
(4)表示CO燃烧热的热化学方程式为. .
查看习题详情和答案>>
①H2(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CO(g)═C(s)+
| 1 |
| 2 |
④C(s)+O2(g)═CO2(g);△H=-393.5kJ?mol-1
回答下列问题:
(1)上述反应中属于放热反应的是
(2)H2的燃烧热△H=
(3)燃烧10g H2生成液态水,放出的热量为
(4)表示CO燃烧热的热化学方程式为.
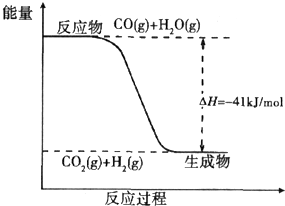 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.(1)用煤可以制得水煤气.工业上可用煤和水通过水煤气法制氢气,已知下列热化学方程式:
C(s)+
| 1 | 2 |
2H2(g)+O2(g)=2H2O(g)△H2=-483.6kJ/mol
试求水煤气法制氢气的反应的反应热△H3.
C(s)+H2O(g)=CO(g)+H2(g)△H3=
+131.3
+131.3
kJ/mol(2)已知一氧化碳与水蒸气反应过程的能量变化如图所示:则此反应为
放热
放热
(填“吸热”或“放热”)反应,反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol
.