摘要:若要使1 mol甲烷完全和氯气发生取代反应.并生成相同物质的量的四种取代物.则需 要氯气的物质的量为 A. 2.5 mol B.2.0 mol C.1.25 mol D.0.5mol
网址:http://m.1010jiajiao.com/timu_id_4423045[举报]
若要使0.5mol甲烷完全和Cl2发生取代反应,并生成相同物质的量的四种取代物,则需要Cl2的物质的量为
[ ]
A.0.5
mol
B.1.25
mol
C.2 mol
D.2.5
mol
若要使0.5mol甲烷完全和Cl2发生取代反应,并生成相同物质的量的四种取代物,则需要Cl2的物质的量为
[ ]
|
A.0.5 mol |
B.1.25 mol C.2 mol D.2.5 mol |
|
|
(2012?宜春模拟)Ⅰ.已知a、b、c、d、e为短周期主族元素.其中
①a和b属同周期元素,二者能形成多种气态化合物;
②a和c属同周期元素,二者能形成两种气态化合物;
③a和d属同主族元素,二者能形成两种常见化合物;
④e可分别和a、b、c、d形成具有相同电子数的共价化合物甲、乙、丙、丁.
请回答:
(1)a元素为
 .
.
(2)由上述一种或几种元素形成的物质可与水发生氧化还原反应但不属于置换反应,写出一个符合要求的化学反应方程式:
Ⅱ.碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活.
已知①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=-1214.6kJ/mol;
②CO2 (g)═CO (g)+
O2(g);△H2=+283kJ/mol
则甲烷燃烧热的热化学方程式为
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1中,以v(H2)表示的平均反应速率为:
②该反应的正反应为
③若要使实验3达到平衡状态时各物质的体积分数与实验2分别相等,则a、b应满足的关系是
查看习题详情和答案>>
①a和b属同周期元素,二者能形成多种气态化合物;
②a和c属同周期元素,二者能形成两种气态化合物;
③a和d属同主族元素,二者能形成两种常见化合物;
④e可分别和a、b、c、d形成具有相同电子数的共价化合物甲、乙、丙、丁.
请回答:
(1)a元素为
氧
氧
,甲的分子式为H2O2
H2O2
,丁的电子式为

(2)由上述一种或几种元素形成的物质可与水发生氧化还原反应但不属于置换反应,写出一个符合要求的化学反应方程式:
3NO2+H2O=NO+2HNO3
3NO2+H2O=NO+2HNO3
.Ⅱ.碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活.
已知①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=-1214.6kJ/mol;
②CO2 (g)═CO (g)+
| 1 |
| 2 |
则甲烷燃烧热的热化学方程式为
CH4(g)+2O2(g)═CO2(g)+2H2O(l)的△H=-890.3kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)的△H=-890.3kJ/mol
.(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
0.16
0.16
mol/L?min.②该反应的正反应为
放
放
(填“吸”或“放”)热反应;③若要使实验3达到平衡状态时各物质的体积分数与实验2分别相等,则a、b应满足的关系是
b=2a
b=2a
(用含a、b表示).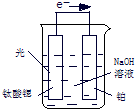 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.(1)直接热分解法制氢.某温度下,H2O(g)?H2(g)+
| 1 |
| 2 |
c(H2)c
| ||
| c(H2O) |
c(H2)c
| ||
| c(H2O) |
(2)热化学循环制氢.制备H2的反应步骤如下:
①Br2(g)+CaO(s)═CaBr2(s)+
| 1 |
| 2 |
②3FeBr2(s)+4H2O(g)═Fe3O4(s)+6HBr(g)+H2(g)△H=+384kJ?mol-1
③CaBr2(s)+H2O (g)═CaO(s)+2HBr(g)△H=+212kJ?mol-1
④Fe3O4(s)+8HBr(g)═Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ?mol-1
则 H2O(g)?H2(g)+
| 1 |
| 2 |
+249
+249
kJ?mol-1.(3)光电化学分解制氢,其原理如图.钛酸锶光电极的电极反应为4OH--4e-═O2+2H2O,则铂电极的电极反应为
2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑)
2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑)
.(4)水煤气法制氢.
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
<
<
1(填“>”、“<”或“=”).②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
x<3
x<3
.(5)甲烷制氢.将1.0mol CH4和2.0mol H2O (g)通入容积为100L的反应室,在一定条件下发生反应:CH4(g)+H2O(g)═CO(g)+3H2(g).测得达到平衡所需的时间为5min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为
0.003 mol?L-1?min-1
0.003 mol?L-1?min-1
.(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质.该反应的化学方程式为
2LiBH4═2LiH+2B+3H2↑
2LiBH4═2LiH+2B+3H2↑
.