题目内容
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.(1)直接热分解法制氢.某温度下,H2O(g)?H2(g)+
| 1 |
| 2 |
c(H2)c
| ||
| c(H2O) |
c(H2)c
| ||
| c(H2O) |
(2)热化学循环制氢.制备H2的反应步骤如下:
①Br2(g)+CaO(s)═CaBr2(s)+
| 1 |
| 2 |
②3FeBr2(s)+4H2O(g)═Fe3O4(s)+6HBr(g)+H2(g)△H=+384kJ?mol-1
③CaBr2(s)+H2O (g)═CaO(s)+2HBr(g)△H=+212kJ?mol-1
④Fe3O4(s)+8HBr(g)═Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ?mol-1
则 H2O(g)?H2(g)+
| 1 |
| 2 |
+249
+249
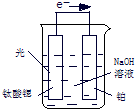
kJ?mol-1.(3)光电化学分解制氢,其原理如图.钛酸锶光电极的电极反应为4OH--4e-═O2+2H2O,则铂电极的电极反应为
2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑)
2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑)
.(4)水煤气法制氢.
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
<
<
1(填“>”、“<”或“=”).②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
x<3
x<3
.(5)甲烷制氢.将1.0mol CH4和2.0mol H2O (g)通入容积为100L的反应室,在一定条件下发生反应:CH4(g)+H2O(g)═CO(g)+3H2(g).测得达到平衡所需的时间为5min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为
0.003 mol?L-1?min-1
0.003 mol?L-1?min-1
.(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质.该反应的化学方程式为
2LiBH4═2LiH+2B+3H2↑
2LiBH4═2LiH+2B+3H2↑
.分析:(1)依据化学平衡常数的概念和化学方程式列式得到;
(2)依据盖斯定律和热化学方程式计算得到所需要的热化学方程式;
(3)用原电池原理和电极书写方法写出,依据装置图分析反应实质是电解水;
(4)①反应是放热反应,升高温度,平衡逆向进行,平衡常数减小;
②若要使上述反应开始时向正反应方向进行,浓度商小于平衡常数计算判断;
(5)依据甲烷的消耗量计算甲烷的化学反应速率,结合速率之比等于化学方程式中的计量数之比计算得到氢气表示的反应速率;
(6)依据分解产物配平书写化学方程式.
(2)依据盖斯定律和热化学方程式计算得到所需要的热化学方程式;
(3)用原电池原理和电极书写方法写出,依据装置图分析反应实质是电解水;
(4)①反应是放热反应,升高温度,平衡逆向进行,平衡常数减小;
②若要使上述反应开始时向正反应方向进行,浓度商小于平衡常数计算判断;
(5)依据甲烷的消耗量计算甲烷的化学反应速率,结合速率之比等于化学方程式中的计量数之比计算得到氢气表示的反应速率;
(6)依据分解产物配平书写化学方程式.
解答:解(1)某温度下,H2O(g)?H2(g)+
O2(g),该反应的平衡常数表达式为K=
,
故答案为:
;
(2)①Br2(g)+CaO(s)═CaBr2(s)+
O2(g)△H=-73kJ?mol-1
②3FeBr2(s)+4H2O(g)═Fe3O4(s)+6HBr(g)+H2(g)△H=+384kJ?mol-1
③CaBr2(s)+H2O(g)═CaO(s)+2HBr(g)△H=+212kJ?mol-1
④Fe3O4(s)+8HBr(g)═Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ?mol-1
则由盖斯定律①+②+③+④得到:H2O(g)?H2(g)+
O2(g)△H=+249KJ/mol;
故答案为:+249;
(3)钛酸锶光电极的电极反应为4OH--4e-═O2+2H2O,图分析可知反应的原理是电解原理的应用,实质是电解水,所以铂电极为阴极,氢离子得到电子生成氢气,则铂电极的电极反应2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑),
故答案为:2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);
(4)①CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,所以升高温度到950℃时,达到平衡时K<1;
故答案为:<;
②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,说明此时的浓度商小于平衡常数,
则Q=
<1,
得到x<3,
故答案为:x<3;
(5)甲烷制氢.将1.0mol CH4和2.0mol H2O (g)通入容积为100L的反应室,在一定条件下发生反应,测得达到平衡所需的时间为5min,CH4的平衡转化率为50%,
消耗甲烷物质的量=1.0mol×50%=0.50mol,
甲烷表示的反应速率=
=0.001mol/L?min,
依据化学方程式 CH4(g)+H2O(g)=CO(g)+3H2(g),甲烷和氢气的反应速率之比等于1:3,
则用H2表示该反应的平均反应速率为:0.003mol/L?min,
故答案为:0.003 mol?L-1?min-1;
(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质,依据物质组成分析,非金属单质只能是氢气和硼单质,反应的化学方程式为:2LiBH4═2LiH+2B+3H2↑,
故答案为:2LiBH4═2LiH+2B+3H2↑.
| 1 |
| 2 |
c(H2)c
| ||
| c(H2O) |
故答案为:
c(H2)c
| ||
| c(H2O) |
(2)①Br2(g)+CaO(s)═CaBr2(s)+
| 1 |
| 2 |
②3FeBr2(s)+4H2O(g)═Fe3O4(s)+6HBr(g)+H2(g)△H=+384kJ?mol-1
③CaBr2(s)+H2O(g)═CaO(s)+2HBr(g)△H=+212kJ?mol-1
④Fe3O4(s)+8HBr(g)═Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ?mol-1
则由盖斯定律①+②+③+④得到:H2O(g)?H2(g)+
| 1 |
| 2 |
故答案为:+249;
(3)钛酸锶光电极的电极反应为4OH--4e-═O2+2H2O,图分析可知反应的原理是电解原理的应用,实质是电解水,所以铂电极为阴极,氢离子得到电子生成氢气,则铂电极的电极反应2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑),
故答案为:2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);
(4)①CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,所以升高温度到950℃时,达到平衡时K<1;
故答案为:<;
②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,说明此时的浓度商小于平衡常数,
则Q=
| 1.0×x |
| 1.0×3.0 |
得到x<3,
故答案为:x<3;
(5)甲烷制氢.将1.0mol CH4和2.0mol H2O (g)通入容积为100L的反应室,在一定条件下发生反应,测得达到平衡所需的时间为5min,CH4的平衡转化率为50%,
消耗甲烷物质的量=1.0mol×50%=0.50mol,
甲烷表示的反应速率=
| ||
| 5min |
依据化学方程式 CH4(g)+H2O(g)=CO(g)+3H2(g),甲烷和氢气的反应速率之比等于1:3,
则用H2表示该反应的平均反应速率为:0.003mol/L?min,
故答案为:0.003 mol?L-1?min-1;
(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质,依据物质组成分析,非金属单质只能是氢气和硼单质,反应的化学方程式为:2LiBH4═2LiH+2B+3H2↑,
故答案为:2LiBH4═2LiH+2B+3H2↑.
点评:本题考查了热化学方程式书写和盖斯定量的应用,电解原理、原电池原理的分析应用,化学平衡和反应速率计算判断,掌握基础是关键,题目难度中等.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.

 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.