摘要:课本图4-4地壳含量相对较多的是( ).
网址:http://m.1010jiajiao.com/timu_id_4418603[举报]
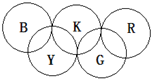 如图所示,形成奥运五环的B、K、R、Y和G均为元素周期表前20号元素的代号,它们还满足下列关系:
如图所示,形成奥运五环的B、K、R、Y和G均为元素周期表前20号元素的代号,它们还满足下列关系:①相邻或相交的两元素均能形成常见化合物.
②B是周期表中原子半径最小的元素.
③K是地壳含量最多的元素,且Y、K两元素同主族.
④G是组成有机化合物的必备元素.
⑤R与其它四种元素既不在同周期,也不在同族.回答下列问题:
(1)K元素在元素周期表中的位置是第
二
二
周期第ⅥA
ⅥA
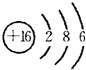
族.(2)Y的原子结构示意图为



(3)B与K形成的化合物与R和G形成的化合物发生反应可用于实验室制取某常见气体,写出该反应的化学方程式
CaC2+2H2O=Ca(OH)2+C2H2↑
CaC2+2H2O=Ca(OH)2+C2H2↑
.(4)任写一个能证明Y和K的非金属性强弱的反应方程式为
2H2S+O2=2S+2H2O
2H2S+O2=2S+2H2O
.图中X、Y、Z、 W是地壳含量前四位(不按顺序)的元素组成的单质,其它为化合物,A有磁性。它们之间存在如下转化关系(部分产物已略去)。

回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 , M的化学式是 ;
(2)胶体的应用非常广泛,早在150年前的1862年,英国科学家格雷阿姆就提出了"胶体"的概念,R胶体中分散质直径大小范围为: ,可利用 区分胶体和溶液;
(3)写出A与 W反应的化学方程式: ;
(4)写出A和足量D的稀溶液反应生成G的离子方程式:
(5)简述检验G溶液中的金属阳离子的实验方法(操作、现象、结论)
(6)工业由E制备Z的反应方程式
查看习题详情和答案>>(2010?潮州二模)Ⅰ.某学校探究性学习小组对84消毒液(有效成份:NaClO溶液)的制备与性质等进行以下探究.
甲同学:为制备84消毒液,制作了一种家用环保型消毒液发生器,设计了如图1所示的装置,用石墨作电极电解饱和氯化钠.请填空:
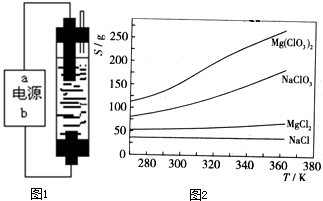
(1)若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a极名称为
(2)用图示的装置电解饱和食盐水制备84消毒液(NaClO溶液)的离子方程式为
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L.可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用.切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品.本品须密封,置阴凉暗处保存.
请完成以下实验探究过程:
阅读材料,根据学过的知识判断问题:
(3)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是(用离子方程式表示)
(4)查得弱酸的电离常数:H2CO3K1=4.4×10-7,K2=4.7×10-11;HClO K=3×10-8.
从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示):
Ⅱ.Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如图2所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
②按①中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
查看习题详情和答案>>
甲同学:为制备84消毒液,制作了一种家用环保型消毒液发生器,设计了如图1所示的装置,用石墨作电极电解饱和氯化钠.请填空:

(1)若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a极名称为
负
负
极(填“正”、“负”),连接a极的电极反应式为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
.(2)用图示的装置电解饱和食盐水制备84消毒液(NaClO溶液)的离子方程式为
Cl-+H2O
ClO-+H2↑或2Cl-+2H2O
2OH-+H2↑+Cl2↑、Cl2+2OH-=ClO-+Cl-+H2O
| ||
| ||
Cl-+H2O
ClO-+H2↑或2Cl-+2H2O
2OH-+H2↑+Cl2↑、Cl2+2OH-=ClO-+Cl-+H2O
.
| ||
| ||
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L.可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用.切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品.本品须密封,置阴凉暗处保存.
请完成以下实验探究过程:
阅读材料,根据学过的知识判断问题:
(3)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是(用离子方程式表示)
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
.(4)查得弱酸的电离常数:H2CO3K1=4.4×10-7,K2=4.7×10-11;HClO K=3×10-8.
从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示):
NaClO+CO2+H2O=NaHCO3+HClO、2HClO
2HCl+O2↑
| ||
NaClO+CO2+H2O=NaHCO3+HClO、2HClO
2HCl+O2↑
.
| ||
Ⅱ.Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如图2所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
在某一温度时,NaCl最先达到饱和析出,Mg(ClO3)2的溶解度随温度变化的最大,NaCl的溶解度与其他物质的溶解度有一定的差别
在某一温度时,NaCl最先达到饱和析出,Mg(ClO3)2的溶解度随温度变化的最大,NaCl的溶解度与其他物质的溶解度有一定的差别
.②按①中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
降温前,溶液中NaCl已达饱和,降温过程中,NaCl溶解度会略为降低,会有少量晶体析出
降温前,溶液中NaCl已达饱和,降温过程中,NaCl溶解度会略为降低,会有少量晶体析出
.(2013?江苏二模)氮的化合物合成、应用及氮的固定一直是科学研究的热点.
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ?mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ?mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ?mol-1
则a为
(2)反应2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g) 在合成塔中进行.图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况.

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O.
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳.若烟气中V(NO):V(NO2)=5:1时,可通入一定量的空气,同温同压下,V(空气):V(NO)=
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式
查看习题详情和答案>>
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ?mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ?mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ?mol-1
则a为
+72.49
+72.49
.(2)反应2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g) 在合成塔中进行.图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况.

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为
A
A
(选填序号).②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是
氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本
氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本
.(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O.
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳.若烟气中V(NO):V(NO2)=5:1时,可通入一定量的空气,同温同压下,V(空气):V(NO)=
1:1
1:1
(空气中氧气的体积含量大约为20%).②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为
5
5
%.(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式
N2+6e-+8H+=2NH4+
N2+6e-+8H+=2NH4+
.生产中可分离出的物质A的化学式为NH4Cl
NH4Cl
.