题目内容
短周期元素ABCD原子序数依次增大.A元素原子核内无中子;B元素原子核外最外层电子数是次外层电子数的2倍;C元素是地壳含量最多的元素;D在短周期元素中金属性最强.请回答:
(1)B在元素周期表中的位置是 .
(2)A与C可形成10电子分子,其化合物类型为 (填“离子”或“共价”)化合物.
(3)A与C还可以形成一种18电子分子,向其溶液中加入少量二氧化锰粉末,反应的化学方程式为 .
(4)D与C按原子个数比为1:1组成的化合物与BC2反应的化学方程式为 .
(1)B在元素周期表中的位置是
(2)A与C可形成10电子分子,其化合物类型为
(3)A与C还可以形成一种18电子分子,向其溶液中加入少量二氧化锰粉末,反应的化学方程式为
(4)D与C按原子个数比为1:1组成的化合物与BC2反应的化学方程式为
分析:短周期元素A、B、C、D原子序数依次增大.A元素原子核内无中子,则A为H元素;B元素原子核外最外层电子数是次外层电子数的2倍,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;C元素是地壳含量最多的元素,则C为O元素;D在短周期元素中金属性最强,则D为Na,据此解答.
解答:解:短周期元素A、B、C、D原子序数依次增大.A元素原子核内无中子,则A为H元素;B元素原子核外最外层电子数是次外层电子数的2倍,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;C元素是地壳含量最多的元素,则C为O元素;D在短周期元素中金属性最强,则D为Na,
(1)B为C元素,原子核外有2个电子层,最外层电子数为4,则位于周期表第二周期ⅣA族,
故答案为:第二周期ⅣA族;
(2)H与O可形成10电子分子为H2O,属于共价化合物,
故答案为:共价;
(3)H与O还可以形成一种18电子分子为H2O2,向其溶液中加入少量二氧化锰粉末,H2O2分解生成H2O、O2,反应的化学方程式为:2H2O2
2H2O+O2↑,
故答案为:2H2O2
2H2O+O2↑;
(4)Na与O按原子个数比为1:1组成的化合物为Na2O2,与CO2反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+2CO2═2Na2CO2+O2,
故答案为:2Na2O2+2CO2═2Na2CO2+O2.
(1)B为C元素,原子核外有2个电子层,最外层电子数为4,则位于周期表第二周期ⅣA族,
故答案为:第二周期ⅣA族;
(2)H与O可形成10电子分子为H2O,属于共价化合物,
故答案为:共价;
(3)H与O还可以形成一种18电子分子为H2O2,向其溶液中加入少量二氧化锰粉末,H2O2分解生成H2O、O2,反应的化学方程式为:2H2O2
| ||
故答案为:2H2O2
| ||
(4)Na与O按原子个数比为1:1组成的化合物为Na2O2,与CO2反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+2CO2═2Na2CO2+O2,
故答案为:2Na2O2+2CO2═2Na2CO2+O2.
点评:本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意核外电子排布规律与基础知识的掌握.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
根据部分短周期元素的原子半径及主要化合价信息,判断以下叙述正确的是( )
|
(7分)根据下表信息回答以下问题:部分短周期元素的原子半径及主要化合价。
| 元素 | A | B | C | D |
| 原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 |
| 元素 | E | F | G | H |
| 原子半径(nm) | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要化合价 | -2 | +1 | +1 | +7,-1 |
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是________。
(3)实验室中制取H单质反应的化学方程式是________。
(4)将A、B两种元素的单质用导线连接浸入NaOH溶液中,发现导线中有电流产生,其负极反应式为________。
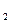 反应的化学方程式为
反应的化学方程式为