摘要: HCO3-+H2OH2CO3+OH-,⑴乙,⑵等于,⑶乙,常压下加热NaHCO3的水溶液.溶液的温度达不到150℃
网址:http://m.1010jiajiao.com/timu_id_4417923[举报]
表示下列变化的化学用语正确的是( )
| A、NaHCO3的水解:HCO3-+H2O?H3O++CO32- | B、明矾溶液中加入过量的氨水 Al3++4OH-?AlO2-+2H2O | C、钢铁吸氧腐蚀的正极反应式:4OH--4e-?O2↑+2H2O | D、1 L0.5 mol?L-1稀硫酸与1 L1 mol?L-1氢氧化钠溶液反应放出57.3 kJ的热:H2SO4(aq)+2NaOH(aq)?Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol |
 (2011?德州二模)短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是自然界含量最多的元素,从是同周期中金属性最强的元素,M的负一价离子与Z的某种氢化物分子含有相同的电子数.
(2011?德州二模)短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是自然界含量最多的元素,从是同周期中金属性最强的元素,M的负一价离子与Z的某种氢化物分子含有相同的电子数.(l) X、Z、W形成的化合物中含有的化学键类型为
离子键、共价键
离子键、共价键
;(2)A是由Y、Z、W三元素共同构成的常见化合物,其水溶液呈碱性,用离子方程式表示其原因
CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-
CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-
.写出表示溶液中所有离子浓度关系的等式c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-)
c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-)
(3)已知①M-M→2M△H=+a kJ?mol-1 ②2X?→X-X△H=-b kJ?mol-1
③M?+X?→XM△H=-c kJ?mol-1写出298K时,X2与M2反应的热化学方程式
H2(g)+Cl2(g)═2HCl(g);△H=(a+b-2c)KJ?mol-1
H2(g)+Cl2(g)═2HCl(g);△H=(a+b-2c)KJ?mol-1
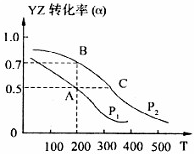
(4)若在密闭容器中充有10mol YZ与20mol X2,在催化剂作用下反应生成甲醇,YZ的转化率(α)与温度、压强的关系如图所示
①Pl
小于
小于
P2(填“大于”、“小于”或“等于”)②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=
1(mol/l)-2
1(mol/l)-2
③若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
大于
大于
tC(填“大于”、“小于”或“等于”)④在不改变反应物用量情况下,为提高YZ转化率可采取的措施是
降温、加压
降温、加压
(答出两点即可)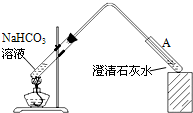 (2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
(2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:| 温度(℃) | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
;(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
大于
大于
(填“大于”或“小于”)NaHCO3;(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH
=
=
8.3(填“>”、“<”或“=”),说明甲正确,若pH>
>
8.3(填“>”、“<”或“=”),说明乙正确;(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明
乙
乙
(填“甲”或“乙”)推测正确;(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断
乙
乙
(填“甲”或“乙”)推测正确,原因是溶液冷却至室温后pH大于8.4,说明此实验过程中溶液有新物质生成
溶液冷却至室温后pH大于8.4,说明此实验过程中溶液有新物质生成
.按要求完成各题
(1)已知,1mol N2(g)与足量O2(g)起反应,生成2mol NO2(g),吸收68kJ的热量.该反应的热化学方程式可表示为:
(2)写出下列各物质的电离方程式:CH3COOH
(3)写出下列各物质水解的离子方程式:NaHCO3
(4)把足量的碳酸钙粉末放入水中,建立的溶解平衡可表示为:
查看习题详情和答案>>
(1)已知,1mol N2(g)与足量O2(g)起反应,生成2mol NO2(g),吸收68kJ的热量.该反应的热化学方程式可表示为:
N2(g)+2O2(g)?2NO2(g)△H=+68KJ/mol
N2(g)+2O2(g)?2NO2(g)△H=+68KJ/mol
(2)写出下列各物质的电离方程式:CH3COOH
?CH3COO-+H+
?CH3COO-+H+
;NH3?H2O?NH4++OH-
?NH4++OH-
(3)写出下列各物质水解的离子方程式:NaHCO3
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
;AlCl3Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
(4)把足量的碳酸钙粉末放入水中,建立的溶解平衡可表示为:
CaCO3(s)?Ca2+(aq)+CO32-(aq)
CaCO3(s)?Ca2+(aq)+CO32-(aq)
.