网址:http://m.1010jiajiao.com/timu_id_441184[举报]
 Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是
(2)原溶液中含有的阳离子是
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为
Ⅱ.草酸亚铁晶体(FeC2O4?2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4).草酸亚铁晶体在氩气气氛中进行热重分析,结果如图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为:
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
|
|
| A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 |
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___ 、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
查看习题详情和答案>>
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
| | | A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下: 查看习题详情和答案>>
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
|
阴离子 |
SO42-、NO3-、Cl- |
|
阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
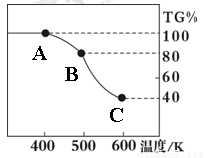
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
查看习题详情和答案>>
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
|
|
|
A-B |
A=B |
A≡B |
|
CO |
键能(kJ/mol) |
357.7 |
798.9 |
1071.9 |
|
键能差值kJ/mol) |
441.2 273 |
|||
|
N2 |
键能(kJ/mol) |
154.8 |
418.4 |
941.7 |
|
键能差值kJ/mol) |
263.6 523.3 |
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___ 、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
查看习题详情和答案>>