题目内容
 Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是
(2)原溶液中含有的阳离子是
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为
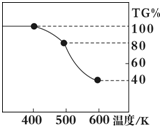
Ⅱ.草酸亚铁晶体(FeC2O4?2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4).草酸亚铁晶体在氩气气氛中进行热重分析,结果如图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为:
分析:Ⅰ、各种离子的物质的量均为1mol,某同学向原溶液中加入KSCN溶液,无明显变化,则一定不含有铁离子,若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是 Fe2+、NO3-在酸性环境下生成的一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有Cl-,再根据电荷守恒确定还含有的其他离子;
Ⅱ、(5)根据化合价规则确定碳元素的化合价;
(6)根据图中提供的信息,通过计算可以判断反应的化学方程式;
(7)草酸亚铁晶体分解产生气体是含有碳元素的化合物:一氧化碳和二氧化碳,第二步释放的气体二氧化碳的相对分子质量较第一步一氧化碳的大,据此来回答.
Ⅱ、(5)根据化合价规则确定碳元素的化合价;
(6)根据图中提供的信息,通过计算可以判断反应的化学方程式;
(7)草酸亚铁晶体分解产生气体是含有碳元素的化合物:一氧化碳和二氧化碳,第二步释放的气体二氧化碳的相对分子质量较第一步一氧化碳的大,据此来回答.
解答:解:Ⅰ、各种离子的物质的量均为1mol,某同学向原溶液中加入KSCN溶液,无明显变化,则一定不含有铁离子,若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是Fe2+、NO3-在酸性环境下生成的一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有Cl-,若只含有氯离子和硝酸根离子,二者的量均为1mol,根据电何守恒是不可能的,所以还含有硫酸根离子,再根据电荷守恒确定还含有一种带有两个正电荷的铜离子,所以含有的五种离子为:Cl-、NO3-、SO42-;Fe2+、Cu2+;
(1)原溶液中含有亚铁离子、硝酸根离子,先向原溶液中加入过量的盐酸,亚铁离子会被硝酸氧化为三价铁离子,再加入KSCN溶液,溶液呈红色,故答案为:溶液呈红色;
(2)溶液中含有的五种离子为:Cl-、NO3-、SO42-;Fe2+、Cu2+,阳离子为:Fe2+、Cu2+,故答案为:Fe2+、Cu2+;
(3)向原溶液中加入足量的盐酸,亚铁离子会被硝酸氧化为三价铁离子,发生反应的离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体有氧化铜和氧化铁,氧化铜的物质的量是1mol,质量是80g,氧化铁物质的量是0.5mol,质量还是80g,总质量是160.0g,天平称量结果到小数点后面一位,故答案为:160.0g;
(5)草酸亚铁晶体中,铁为+2价,氧元素为-2价,H为+1价,根据化合价规则,得到碳元素化合价是+3价,故答案为:+3;
(6)通过剩余固体的质量占原样品总质量的百分数可知,过程A→B发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4?2H2O
FeC2O4+2H2O↑,故答案为:FeC2O4?2H2O
FeC2O4+2H2O↑;
(7)草酸亚铁晶体分解产生气体是含有碳元素的化合物:一氧化碳和二氧化碳,第二步释放的气体的相对分子质量较第一步的大,所以第一步释放的气体化学式为:CO,第二步是FeCO3
FeO+CO2↑,释放的气体是二氧化碳,故答案为:CO;FeCO3
FeO+CO2↑.
(1)原溶液中含有亚铁离子、硝酸根离子,先向原溶液中加入过量的盐酸,亚铁离子会被硝酸氧化为三价铁离子,再加入KSCN溶液,溶液呈红色,故答案为:溶液呈红色;
(2)溶液中含有的五种离子为:Cl-、NO3-、SO42-;Fe2+、Cu2+,阳离子为:Fe2+、Cu2+,故答案为:Fe2+、Cu2+;
(3)向原溶液中加入足量的盐酸,亚铁离子会被硝酸氧化为三价铁离子,发生反应的离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体有氧化铜和氧化铁,氧化铜的物质的量是1mol,质量是80g,氧化铁物质的量是0.5mol,质量还是80g,总质量是160.0g,天平称量结果到小数点后面一位,故答案为:160.0g;
(5)草酸亚铁晶体中,铁为+2价,氧元素为-2价,H为+1价,根据化合价规则,得到碳元素化合价是+3价,故答案为:+3;
(6)通过剩余固体的质量占原样品总质量的百分数可知,过程A→B发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4?2H2O
| ||
| ||
(7)草酸亚铁晶体分解产生气体是含有碳元素的化合物:一氧化碳和二氧化碳,第二步释放的气体的相对分子质量较第一步的大,所以第一步释放的气体化学式为:CO,第二步是FeCO3
| ||
| ||
点评:学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
|
阴离子 |
SO42-、NO3-、Cl- |
|
阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:

(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。

 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究. A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示: