摘要:考点3.有关天平平衡问题的计算 有关天平平衡问题的计算一般是在平衡的天平两边的反应容器内加入不同的反应物.通过计算判断天平是否平衡.解答天平平衡问题可采用如下分析方法:设加到天平左.右两盘容器内的物质质量分别为m.m,左.右两盘容器内放出的气体质量分别为m.m,左.右两盘实际增重为△m(左).△m(右).即△m(左)= m- m,△m(右)= m- m. 则当△m(左) 正确找出或求出m.m.m.m是解此类题的关键.
网址:http://m.1010jiajiao.com/timu_id_4410452[举报]
化学是一门一实验为基础的科学,如图1~4是教科书上有关实验的装置图.下列说法正确的是( )

A、图1实验可以得到的结论是:氧气约占空气质量的
| ||
| B、图2中发现A烧杯中的液体有无色变为红色,说明分子在不断运动 | ||
| C、图3通电一段时间后,切断电源,正极端与负极端的玻璃管内产生的气体体积比为2:1 | ||
| D、图4盐酸与碳酸钠粉末反应前天平平衡,则反应后天平的指针会偏向右 |
为探索物质在化学变化前后的质量关系,科学家做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验.他将金属放在密闭容器中煅烧,煅烧后他立即打开容器盖进行称量,结果发现反应后的固体质量增加了.该实验导致波义耳未能发现质量守恒定律.之后俄国化学家罗蒙诺索夫在密闭玻璃瓶内燃烧金属,发现反应后质量不变,由此得出反应前后的质量守恒.
这两位科学家的实验相似,为何结论不同?某研究小组沿着科学家的足迹进行探究,请你完成以下相关内容:
(1)【交流讨论】两位科学家得出不同的结论究竟与哪些实验因素有关呢?
(2)【提出假设】若用同种金属,同一容器进行实验,两位科学家得出不同的结论主要是由于
(3)【实验验证】已知:钠在空气中受热燃烧生成过氧化钠固体.
(4)【得出结论】假设成立.
(5)依据以上实验事实,解释两位科学家的实验结论:
查看习题详情和答案>>
这两位科学家的实验相似,为何结论不同?某研究小组沿着科学家的足迹进行探究,请你完成以下相关内容:
(1)【交流讨论】两位科学家得出不同的结论究竟与哪些实验因素有关呢?
(2)【提出假设】若用同种金属,同一容器进行实验,两位科学家得出不同的结论主要是由于
反应容器敞开与密闭的差异
反应容器敞开与密闭的差异
的缘故.(3)【实验验证】已知:钠在空气中受热燃烧生成过氧化钠固体.
| 操作步骤及实验现象 | 简答 |
| (1)在底部铺有细沙的锥形瓶中,放入一小块金属钠,塞紧橡皮塞,称量,用砝码使天平平衡. | 称量前需 检查天平是否平衡 检查天平是否平衡 . |
| (2)取下锥形瓶,放在垫有石棉网的三角架上微热,观察到金属钠着火燃烧,冷却后,再称量. | 称量时观察到 天平保持平衡 天平保持平衡 . |
| (3)将锥形瓶瓶塞取出一会儿后,盖上瓶塞,再称量. | 称量时观察到 天平指针向左偏移 天平指针向左偏移 . |
(5)依据以上实验事实,解释两位科学家的实验结论:
波义尔在敞口容器中实验,消耗氧气后,又不断补充空气,因此质量增加;而罗蒙诺索夫是在密闭容器中进行,质量不变
波义尔在敞口容器中实验,消耗氧气后,又不断补充空气,因此质量增加;而罗蒙诺索夫是在密闭容器中进行,质量不变
.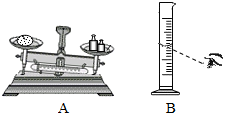 味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl(其他成分不考虑).请你与小军一起测定NaCl在味精中的质量分数,回答下列问题:
味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl(其他成分不考虑).请你与小军一起测定NaCl在味精中的质量分数,回答下列问题:(1)味精中至少含有
5
5
种元素(填数字);(2)称取5.0g味精配制成50g溶液.称量时出现了如下图A所示右盘低的现象,接下来的操作应该是
④
④
.①左边的平衡螺母向左调至天平平衡
②移动游码至天平平衡
③右盘中减少砝码至天平平衡
④左盘中添加味精至天平平衡
(3)在其他操作均正确的情况下,在配制溶液过程中,小军采取图B方式量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数
偏小
偏小
(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCl的质量分数无影响
无影响
(填“偏大”、“偏小”或“无影响”).(4)向所配制的50g溶液中加入过量的AgNO3溶液使氯化钠完全沉淀,反应方程式为
AgNO3+NaCl=AgCl↓+NaNO3
AgNO3+NaCl=AgCl↓+NaNO3
,检验沉淀是否完全的方法是:静置后,在上层清液中加入AgNO3
AgNO3
溶液(填化学式),观察是否有沉淀生成.过滤后,洗涤、干燥、称量AgCl固体.洗涤的目的是洗去AgCl固体表面的可溶性杂质,可溶性杂质中一定有NaNO3、AgNO3、C5H8NO4Na
NaNO3、AgNO3、C5H8NO4Na
.经精确测定AgCl沉淀质量为2.87g,则该味精中NaCl的质量分数为23.4%
23.4%
.(有关物质的相对分子质量:NaCl 58.5,AgCl 143.5 )实验是学习化学的重要手段,请阅读下列实验装置图,回答有关问题.
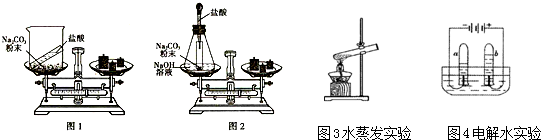
(1)同学们先按图1的方式实验,该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是 (填序号).
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是 (填序号).
A.左盘高 B.右盘高 C.保持平衡
(3)比较图3和图4两个实验中水的变化,用分子原子的观点分析其不同点: ;图4中b得到的气体为 .
查看习题详情和答案>>

(1)同学们先按图1的方式实验,该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是
| A | B | C | D | |
| 盐酸加入Na2 CO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
| 盐酸加入Na2 CO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
A.左盘高 B.右盘高 C.保持平衡
(3)比较图3和图4两个实验中水的变化,用分子原子的观点分析其不同点:
