题目内容
 味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl(其他成分不考虑).请你与小军一起测定NaCl在味精中的质量分数,回答下列问题:
味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl(其他成分不考虑).请你与小军一起测定NaCl在味精中的质量分数,回答下列问题:(1)味精中至少含有
5
5
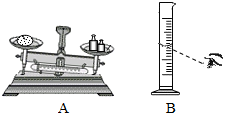
种元素(填数字);(2)称取5.0g味精配制成50g溶液.称量时出现了如下图A所示右盘低的现象,接下来的操作应该是
④
④
.①左边的平衡螺母向左调至天平平衡
②移动游码至天平平衡
③右盘中减少砝码至天平平衡
④左盘中添加味精至天平平衡
(3)在其他操作均正确的情况下,在配制溶液过程中,小军采取图B方式量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数
偏小
偏小
(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCl的质量分数无影响
无影响
(填“偏大”、“偏小”或“无影响”).(4)向所配制的50g溶液中加入过量的AgNO3溶液使氯化钠完全沉淀,反应方程式为
AgNO3+NaCl=AgCl↓+NaNO3
AgNO3+NaCl=AgCl↓+NaNO3
,检验沉淀是否完全的方法是:静置后,在上层清液中加入AgNO3
AgNO3
溶液(填化学式),观察是否有沉淀生成.过滤后,洗涤、干燥、称量AgCl固体.洗涤的目的是洗去AgCl固体表面的可溶性杂质,可溶性杂质中一定有NaNO3、AgNO3、C5H8NO4Na
NaNO3、AgNO3、C5H8NO4Na
.经精确测定AgCl沉淀质量为2.87g,则该味精中NaCl的质量分数为23.4%
23.4%
.(有关物质的相对分子质量:NaCl 58.5,AgCl 143.5 )分析:(1)根据味精中主要成分的化学式,判断其组成元素.
(2)称量前要先计算,称量时先将调平的天平的砝码和游码设置为要达到的数值(本题为5),之后的称量过程不能在动砝码和游码(这个和称量一个物品的质量恰好相反).
(3)量取液体时,视线要与凹液面最低处保持水平,由于需要的水的体积是确定的,所以开始视线就是盯着刻度的,当仰视时,实际加入的液体的体积大于目标数值;仰视读数时,所读出的体积小于实际液体的体积;配制味精溶液只是为了在溶液内进行反应,数据处理时与此质量分数无关.
(4)可采取再滴加硝酸银溶液的方法,观察是否有沉淀,若无沉淀说明已经沉淀完全;沉淀表面沾有溶液,因此干燥时溶液中的溶质混入沉淀;根据反应的化学方程式,由生成沉淀的质量计算味精中所含量NaCl的质量,并求出该味精中NaCl的质量分数.
(2)称量前要先计算,称量时先将调平的天平的砝码和游码设置为要达到的数值(本题为5),之后的称量过程不能在动砝码和游码(这个和称量一个物品的质量恰好相反).
(3)量取液体时,视线要与凹液面最低处保持水平,由于需要的水的体积是确定的,所以开始视线就是盯着刻度的,当仰视时,实际加入的液体的体积大于目标数值;仰视读数时,所读出的体积小于实际液体的体积;配制味精溶液只是为了在溶液内进行反应,数据处理时与此质量分数无关.
(4)可采取再滴加硝酸银溶液的方法,观察是否有沉淀,若无沉淀说明已经沉淀完全;沉淀表面沾有溶液,因此干燥时溶液中的溶质混入沉淀;根据反应的化学方程式,由生成沉淀的质量计算味精中所含量NaCl的质量,并求出该味精中NaCl的质量分数.
解答:解:(1)由味精主要成分“谷氨酸钠”化学式是C5H8NO4Na可知,其中含有C、H、N、O、Na五种元素;
(2)在称量过程,调平托盘天平后,将砝码和游码设定为5g,之后慢慢加入氯化钠到天平平衡,而不能在动砝码和游码.当出现右侧偏低(左物右码,右侧为砝码一侧),说明加入的氯化钠不足,因此需要增加左盘的食盐.
(2)本实验需要用到的水的质量为50g-5g=45g,其体积为45mL.对于液体,需要用量筒量取.在量取过程中,视线要一直盯着刻度45,且是水平于凹液面的.所以当如图所示读数时,会导致量取的液体偏多,由于溶剂增大,所以会导致溶液的谷氨酸钠的溶质的质量分数偏小.味精中NaCl的质量分数=
×100%,将不会受到影响.
(4)氯化钠与硝酸银溶液能发生化学反应,生成白色沉淀,反应化学方程式为AgNO3+NaCl═AgCl↓+NaNO3;向清液中再滴加硝酸银溶液,若观察到无明显现象说明原来已经完全沉淀;由于反应后的溶液为生成的硝酸钠和加入过量的硝酸银的混合溶液,因此,一定混有的可溶性杂质为C5H8NO4Na(原混合物中的)、NaNO3、AgNO3;
设氯化钠的质量为x
NaCl+AgNO3═AgCl↓+NaNO3
58.5 143.5
x 2.87g
=
x=1.17g
该味精中NaCl的质量分数=
×100%=23.4%
故答案为:每空(1分) (1)5 (2)④(3)偏小;无影响;(4)AgNO3+NaCl=AgCl↓+Na NO3 ;AgNO3;Na NO3、AgNO3、C5H8NO4Na(少一个就不得分); 23.4%
(2)在称量过程,调平托盘天平后,将砝码和游码设定为5g,之后慢慢加入氯化钠到天平平衡,而不能在动砝码和游码.当出现右侧偏低(左物右码,右侧为砝码一侧),说明加入的氯化钠不足,因此需要增加左盘的食盐.
(2)本实验需要用到的水的质量为50g-5g=45g,其体积为45mL.对于液体,需要用量筒量取.在量取过程中,视线要一直盯着刻度45,且是水平于凹液面的.所以当如图所示读数时,会导致量取的液体偏多,由于溶剂增大,所以会导致溶液的谷氨酸钠的溶质的质量分数偏小.味精中NaCl的质量分数=
| 氯化钠质量 |
| 5g |
(4)氯化钠与硝酸银溶液能发生化学反应,生成白色沉淀,反应化学方程式为AgNO3+NaCl═AgCl↓+NaNO3;向清液中再滴加硝酸银溶液,若观察到无明显现象说明原来已经完全沉淀;由于反应后的溶液为生成的硝酸钠和加入过量的硝酸银的混合溶液,因此,一定混有的可溶性杂质为C5H8NO4Na(原混合物中的)、NaNO3、AgNO3;
设氯化钠的质量为x
NaCl+AgNO3═AgCl↓+NaNO3
58.5 143.5
x 2.87g
| 18.5 |
| x |
| 143.5 |
| 2.87g |
该味精中NaCl的质量分数=
| 1.17g |
| 5g |
故答案为:每空(1分) (1)5 (2)④(3)偏小;无影响;(4)AgNO3+NaCl=AgCl↓+Na NO3 ;AgNO3;Na NO3、AgNO3、C5H8NO4Na(少一个就不得分); 23.4%
点评:本题具有较大的综合性,在解答时需要涉及较多的基础知识,因此,需要足够的耐心和毅力.

练习册系列答案
相关题目
 味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na).某品牌味精包装上标注内容如图所示,请回答:
味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na).某品牌味精包装上标注内容如图所示,请回答: