摘要:1.化学计算的常用方法 (1)守恒法:包括原子个数守恒.得失电子守恒.电荷守恒法.质量守恒法等. (2)极值法: 从问题的极端去思考.去推理.判断.使问题得到解决. (3)讨论法:当题中含有不确定的因素时.对每一种可能情况进行的讨论. (4)十字交叉法:已知混合中某一量的平均值.求混合物中两物质的质量比. (5)差量法:运用前后量的差.根据方程式中的计量数的关系直接求解.
网址:http://m.1010jiajiao.com/timu_id_4405129[举报]
(2010?青浦区一模)请结合下列实验室制取气体的常用装置,回答有关问题.
(1)写出图中标有字母的仪器名称:a
(2)若用氯酸钾和二氧化锰的混合物制取氧气,应选用的发生装置是
(3)某同学欲用G装置代替D装置,用排水法收集一种难溶性气体,该同学使用G装置的方法是
(4)实验室如用块状固体和液体无需加热制取气体,可将B装置改进为C装置(多孔隔板用来放块状固体),其优点是
(5)在实验室还可选用B装置用H2O2溶液和MnO2来制取O2.取一瓶久置后的过氧化氢溶液,取 出102g,加入适量的二氧化锰,充分反应后生成氧气的物质的量与反应时间的关系如图所示:
出102g,加入适量的二氧化锰,充分反应后生成氧气的物质的量与反应时间的关系如图所示:
求:
①完全反应后生成氧气质量
②该102g过氧化氢溶液中所含H2O2的物质的量是多少?(列式计算)
③计算该溶液中溶质的质量分数
查看习题详情和答案>>

(1)写出图中标有字母的仪器名称:a
长颈漏斗
长颈漏斗
.(2)若用氯酸钾和二氧化锰的混合物制取氧气,应选用的发生装置是
A
A
(填“A、B或C”),在加入药品前,应首先检查气密性
检查气密性
,反应的化学方程式是2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
.
| ||
| △ |
(3)某同学欲用G装置代替D装置,用排水法收集一种难溶性气体,该同学使用G装置的方法是
先将G装置装满水,气体从c端通入
先将G装置装满水,气体从c端通入
.(4)实验室如用块状固体和液体无需加热制取气体,可将B装置改进为C装置(多孔隔板用来放块状固体),其优点是
可以随时控制气体的发生
可以随时控制气体的发生
.(5)在实验室还可选用B装置用H2O2溶液和MnO2来制取O2.取一瓶久置后的过氧化氢溶液,取
 出102g,加入适量的二氧化锰,充分反应后生成氧气的物质的量与反应时间的关系如图所示:
出102g,加入适量的二氧化锰,充分反应后生成氧气的物质的量与反应时间的关系如图所示:求:
①完全反应后生成氧气质量
0.96g
0.96g
g.②该102g过氧化氢溶液中所含H2O2的物质的量是多少?(列式计算)
③计算该溶液中溶质的质量分数
2%
2%
.
高锰酸钾可以杀灭细菌,是家庭必备的常用消毒药.已知:K2MnO4溶液为绿色溶液.
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是 ,步骤③中获取KMnO4的化学方程式是 .步骤④中高锰酸钾晶体只能低温烘干的原因是 .
(2)带孔隔板上的块状固体是 ,从长颈漏斗中加入的溶液是 .
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、 ,关闭 ,缓慢挤压气囊B,这样往复进行上述操作.当用玻璃棒蘸取溶液点在滤纸上,只有 色,说明反应完全.
(4)该实验设计的优点是 .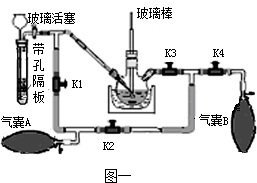
KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置 组合(固定装置略),试管口塞有棉花团的作用是 .
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当 时,收集气体; 酒精灯,冷却后调节量筒高度,并使量筒内外液面相平,读取气体体积.
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取 g(保留两位小数).
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是 .
查看习题详情和答案>>
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是
(2)带孔隔板上的块状固体是
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、
(4)该实验设计的优点是


KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是
(2009?虹口区一模)化学实验中常用的装置如下,请回答下列问题.
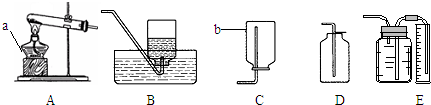
①写出仪器a和b的名称:a
②实验室制取二氧化碳时可以选择的收集装置是
③连接A、E装置,点燃酒精灯,收集氧气并测定其体积.该方法收集到的氧气往往不纯,这对氧气体积的测定
④A中有氯酸钾0.02mol,若完全分解可生成多少摩尔氧气?(请在答题纸上写出计算过程)
⑤经测定反应生成了0.32g氧气,这些氧气的物质的量是
查看习题详情和答案>>

①写出仪器a和b的名称:a
酒精灯
酒精灯
,b集气瓶
集气瓶
.②实验室制取二氧化碳时可以选择的收集装置是
D
D
(填仪器编号).用氯酸钾和二氧化锰为原料制取氧气,催化剂是二氧化锰
二氧化锰
.③连接A、E装置,点燃酒精灯,收集氧气并测定其体积.该方法收集到的氧气往往不纯,这对氧气体积的测定
没有
没有
(填“有”或“没有”)影响,不纯的原因是开始试管内的空气进入集气瓶内
开始试管内的空气进入集气瓶内
.④A中有氯酸钾0.02mol,若完全分解可生成多少摩尔氧气?(请在答题纸上写出计算过程)
⑤经测定反应生成了0.32g氧气,这些氧气的物质的量是
0.01
0.01
mol.此时,A中的氯酸钾没有
没有
(填“有”或“没有”)完全分解.在生活和化学实验中,大家经常需使用多种除湿剂(干燥剂)
(1)生石灰:白色块状固体,吸水后生成熟石灰,该反应的化学方程式为
(2)硅胶:无色或白色颗粒,吸水量为30%-35%,可反复使用.其主要成分可看作是SiO2,其中Si元素的化合价为
(3)浓H2SO4:无色粘稠液体,有吸水性,在化学实验中常用作干燥剂,但日常生活中却很少用作除湿剂,其原因是
(4)无水氯化钙:白色固体,有苦咸味,每千克吸水量约为1-1.2kg.若1kg无水氯化钙吸收1.2kg水后得到氯化钙溶液,该溶液中溶质的质量分数为
(5)还原铁粉:灰色或黑色粉未,又称“双吸剂”能够吸收空气中的水分和氧气,常用于食品保鲜.检验使用一段时间后的“双吸剂”是否有效的化学方法是(选一个化学方程式表示)
查看习题详情和答案>>
(1)生石灰:白色块状固体,吸水后生成熟石灰,该反应的化学方程式为
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
.(2)硅胶:无色或白色颗粒,吸水量为30%-35%,可反复使用.其主要成分可看作是SiO2,其中Si元素的化合价为
+4
+4
价.(3)浓H2SO4:无色粘稠液体,有吸水性,在化学实验中常用作干燥剂,但日常生活中却很少用作除湿剂,其原因是
浓硫酸具有很强的腐蚀性
浓硫酸具有很强的腐蚀性
(写出一条即可)(4)无水氯化钙:白色固体,有苦咸味,每千克吸水量约为1-1.2kg.若1kg无水氯化钙吸收1.2kg水后得到氯化钙溶液,该溶液中溶质的质量分数为
45.5
45.5
%.(计算结果保留小数点后一位数字).(5)还原铁粉:灰色或黑色粉未,又称“双吸剂”能够吸收空气中的水分和氧气,常用于食品保鲜.检验使用一段时间后的“双吸剂”是否有效的化学方法是(选一个化学方程式表示)
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
. 人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.(1)为了验证该药物的主要成分是碳酸镁,通过查阅资料得知其性质与CaCO3相似,于是他首先将药片放入试管中,向其中加入适量的稀盐酸,并在试管口塞一个带导管的橡皮塞,导管的一端通入
澄清的石灰水中
澄清的石灰水中
,实验现象为石灰水变浑浊
石灰水变浑浊
请你写出碳酸镁与稀盐酸的化学方程式
MgCO3+2HCl═MgCl2+H2O+CO2↑
MgCO3+2HCl═MgCl2+H2O+CO2↑
(2)小军看到说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.
提出问题:抗酸药为什么嚼碎后服用?
作出猜想:他的猜想是
嚼碎后服用疗效快
嚼碎后服用疗效快
设计实验:
实验一:将一片完整的药片放入试管中,向其中加入5ml的稀盐酸;
实验二:将
一片研碎的药片
一片研碎的药片
放入试管中,向其中加入与实验一相同浓度相同体积的稀盐酸;现象与结论:实验二比实验一反应快.证明小军的猜想正确.
(3)拓展探究:
①氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药,这些物质必须具备两个条件:一是能与胃酸作用;二是
对身体无害
对身体无害
.②患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是
碳酸盐与胃酸作用生成二氧化碳气体,加重胃溃疡病情
碳酸盐与胃酸作用生成二氧化碳气体,加重胃溃疡病情
.③你还能写出稀盐酸与碳酸氢钠反应的方程式吗?请写出来.
HCl+NaHCO3=NaCl+H2O+CO2↑
HCl+NaHCO3=NaCl+H2O+CO2↑
(4)小军为了进一步测定该药品中碳酸镁的含量,取十片该药品称量,重10g,放入烧杯中,滴加质量分数7.3%的盐酸,直至恰好完全反应,共消耗盐酸100g,根据以上数据,请你计算该药品中碳酸镁的质量分数.