摘要:30.答案: (1)①BaCl2.NaOH.Na2CO3(错选或多选本小题不得分.NaOH溶液的加入顺序及是否答Na0H不影响得分) ②75%乙醇 (2)天平.烧杯.500 mL容量瓶.胶头滴管 (3)< 电解生成的氯气与电解生成的NaOH发生了反应 酸碱中和滴定 (4)c d 解析:(1)①要除去SO42-.只有选BaCl2溶液.若选用Ba(NO3)2.会引入新的离子NO3-.再选用NaOH溶液除去Mg2+和Fe3+溶液.最后选用Na2CO3溶液除去Ca2+.此处不能选用K2CO3溶液.否则会引入新的K+.再用HCl除去过量的CO32-.Na2CO3溶液不能加在BaCl2溶液前.否则会引入Ba2+.②除去NaCl晶体表面的少量的KCl.应选用75%的乙醇.因为CCl4有毒.同时KCl也不会溶解在CCl4中. (3)2NaCl+2H2O2NaOH+Cl2↑+H2↑.在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl.NaClO和H2O.使得部分的Cl2被消耗.所以同样条件下收集到的Cl2小于2L.
网址:http://m.1010jiajiao.com/timu_id_4402398[举报]
(2013?闵行区一模)黄铁矿(主要成分为FeS2)是生产硫酸的主要原料.高温时,黄铁矿在空气中煅烧[设空气中V(N2):V(O2)=4:1且不含其他气体],可发生下列反应:4FeS2+11O2→2Fe2O3+8SO2.
根据题意完成下列计算:
(1)若把2.00g某黄铁矿试样在足量空气中充分灼烧后(杂质不反应、不挥发),得到1.56g残渣,则该黄铁矿的纯度为
(2)煅烧70t黄铁矿(含硫35%,杂质不含硫且不反应)生产出72.8t硫酸铵.若黄铁矿制取硫酸时的利用率为80%,则在制取硫酸铵时硫酸的利用率为
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,煅烧后的混合气体平均相对分子质量为
(4)硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时生产副产品氮肥.已知吸收尾气后的氨水全部转化为铵盐.取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀.通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比.
查看习题详情和答案>>
根据题意完成下列计算:
(1)若把2.00g某黄铁矿试样在足量空气中充分灼烧后(杂质不反应、不挥发),得到1.56g残渣,则该黄铁矿的纯度为
66%
66%
.(2)煅烧70t黄铁矿(含硫35%,杂质不含硫且不反应)生产出72.8t硫酸铵.若黄铁矿制取硫酸时的利用率为80%,则在制取硫酸铵时硫酸的利用率为
90.04%
90.04%
(答案保留两位小数).(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,煅烧后的混合气体平均相对分子质量为
32.71
32.71
(答案保留两位小数).(4)硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时生产副产品氮肥.已知吸收尾气后的氨水全部转化为铵盐.取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀.通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比.
某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
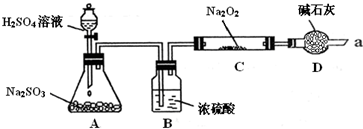
Ⅰ如何检验反应中是否有O2生成 .
Ⅱ装置D除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以 .
Ⅲ对C中固体产物提出如下假设:
假设1:只有Na2SO3 假设2:只有Na2SO4 假设3: .
(1)假设1的反应方程式:2SO2+2Na2O2=
(2)若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置.限选试剂和仪器:酸性KMnO4溶液、Ba(NO3)2溶液、BaCl2溶液、1mol/L HNO3溶液、4mol/L盐酸、试管、胶头滴管
查看习题详情和答案>>

Ⅰ如何检验反应中是否有O2生成
Ⅱ装置D除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以
Ⅲ对C中固体产物提出如下假设:
假设1:只有Na2SO3 假设2:只有Na2SO4 假设3:
(1)假设1的反应方程式:2SO2+2Na2O2=
(2)若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置.限选试剂和仪器:酸性KMnO4溶液、Ba(NO3)2溶液、BaCl2溶液、1mol/L HNO3溶液、4mol/L盐酸、试管、胶头滴管
| 实验操作 | 预期现象 | 结 论 |
| 步骤一:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,分别取少量于A、B试管中 | 固体完全溶解,得到无色透明溶液 | / |
| 步骤二:取试管A,向溶液中加入 |
假设1 或假设3成立;若没有该现象则假设2成立. | |
| 步骤三:取试管B,向其中先加入 再加入 |
产生 再加入试剂看到产生白色沉淀. |
假设3成立.若无白色沉淀产生则假设1成立. |
(2011?闵行区二模)天然水由于长期与土壤、岩石等接触,会溶有一定量的Ca2+、Mg2+、HCO3-等,这样的水在加热过程中很容易形成水垢.水垢可以看作由多种物质如:CaCO3、MgCO3、Mg(OH)2等中的若干种物质组成的混合物,某学习小组为研究含有Ca2+、Mg2+、HCO3-的自来水所形成水垢的化学组成,取干燥的水垢6.32g,加热使其失去结晶水后,得到5.78g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用足量Ba(OH)2溶液吸收,得到11.82g沉淀.
(1)通过计算确定A中的碳酸盐是
a.只有CaCO3 b.只有MgCO3 c.既有CaCO3又有MgCO3
写出计算过程:
(2)5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量.若用a CaCO3?b MgCO3?x Mg(OH)2?y H2O表示原水垢(若a、b、x、y中有为0的,则该项略去,a、b、x、y用最简整数比),通过计算确定原水垢的化学式.
(3)该学习小组用该水垢模拟石灰窑反应,取该水垢与碳粉混合,通入一定量空气(假定不考虑其它气体,N2与O2体积比为:4:1),在密闭容器中,用喷灯加热至1000℃左右充分反应后,冷却到室温,测得最后所得气体中各种成分的体积含量如下:
O2:0.3%;CO:0.4%;CO2:42.5%;其余为N2.[已知:Mg(OH)2分解温度为270℃左右,MgCO3分解温度为400℃左右,CaCO3分解温度900℃左右].
求该小组所取水垢和碳粉的质量比(结果保留2位小数).
查看习题详情和答案>>
(1)通过计算确定A中的碳酸盐是
c
c
(填答案编号).a.只有CaCO3 b.只有MgCO3 c.既有CaCO3又有MgCO3
写出计算过程:
n(CO2)=n(BaCO3)=
=0.06mol,假设二氧化碳全部来自碳酸钙,则m(CaCO3)=0.06mol×100g/mol=6g>5.78g,假设二氧化碳全部来自碳酸镁,则m(MgCO3)=0.06mol×84g/mol=5.04g<5.78g,故A既含有CaCO3,又含有MgCO3
| 11.82g |
| 197g/mol |
n(CO2)=n(BaCO3)=
=0.06mol,假设二氧化碳全部来自碳酸钙,则m(CaCO3)=0.06mol×100g/mol=6g>5.78g,假设二氧化碳全部来自碳酸镁,则m(MgCO3)=0.06mol×84g/mol=5.04g<5.78g,故A既含有CaCO3,又含有MgCO3
| 11.82g |
| 197g/mol |
(2)5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量.若用a CaCO3?b MgCO3?x Mg(OH)2?y H2O表示原水垢(若a、b、x、y中有为0的,则该项略去,a、b、x、y用最简整数比),通过计算确定原水垢的化学式.
(3)该学习小组用该水垢模拟石灰窑反应,取该水垢与碳粉混合,通入一定量空气(假定不考虑其它气体,N2与O2体积比为:4:1),在密闭容器中,用喷灯加热至1000℃左右充分反应后,冷却到室温,测得最后所得气体中各种成分的体积含量如下:
O2:0.3%;CO:0.4%;CO2:42.5%;其余为N2.[已知:Mg(OH)2分解温度为270℃左右,MgCO3分解温度为400℃左右,CaCO3分解温度900℃左右].
求该小组所取水垢和碳粉的质量比(结果保留2位小数).
端午节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.
提出问题:这瓶NaOH溶液一定变质了,其变质程度如何呢?
提出猜想:小丽的猜想:NaOH溶液部分变质
你的新猜想:
实验探究:小丽设计如下实验来验证自己的猜想,请根据表中内容填写小丽实验时的现象
假设你的猜想正确,并按小丽的实验方案进行实验,则你观察到的实验现象是:
实验反思:
(1)下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代小丽实验中CaCl2溶液的是
(2)小丽第二次滴加的试剂除用指示剂外,还可以用
拓展应用:保存NaOH溶液的方法是
查看习题详情和答案>>
提出问题:这瓶NaOH溶液一定变质了,其变质程度如何呢?
提出猜想:小丽的猜想:NaOH溶液部分变质
你的新猜想:
NaOH溶液全部变质
NaOH溶液全部变质
.实验探究:小丽设计如下实验来验证自己的猜想,请根据表中内容填写小丽实验时的现象
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液. | NaOH溶液部分变质 |
产生白色沉淀,酚酞试液变红;产生白色沉淀,酚酞试液不变色
产生白色沉淀,酚酞试液变红;产生白色沉淀,酚酞试液不变色
.实验反思:
(1)下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代小丽实验中CaCl2溶液的是
③④
③④
(填序号).(2)小丽第二次滴加的试剂除用指示剂外,还可以用
硫酸铜溶液 (或NH4Cl溶液,其它符合题意的答案酌情给分)
硫酸铜溶液 (或NH4Cl溶液,其它符合题意的答案酌情给分)
替代.拓展应用:保存NaOH溶液的方法是
密封保存
密封保存
.请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中 的平衡浓度,c(
的平衡浓度,c( )平=
)平=