题目内容
某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
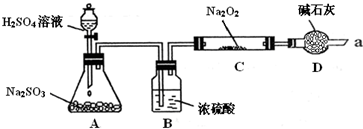
Ⅰ如何检验反应中是否有O2生成 .
Ⅱ装置D除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以 .
Ⅲ对C中固体产物提出如下假设:
假设1:只有Na2SO3 假设2:只有Na2SO4 假设3: .
(1)假设1的反应方程式:2SO2+2Na2O2=
(2)若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置.限选试剂和仪器:酸性KMnO4溶液、Ba(NO3)2溶液、BaCl2溶液、1mol/L HNO3溶液、4mol/L盐酸、试管、胶头滴管

Ⅰ如何检验反应中是否有O2生成
Ⅱ装置D除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以
Ⅲ对C中固体产物提出如下假设:
假设1:只有Na2SO3 假设2:只有Na2SO4 假设3:
(1)假设1的反应方程式:2SO2+2Na2O2=
(2)若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置.限选试剂和仪器:酸性KMnO4溶液、Ba(NO3)2溶液、BaCl2溶液、1mol/L HNO3溶液、4mol/L盐酸、试管、胶头滴管
| 实验操作 | 预期现象 | 结 论 |
| 步骤一:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,分别取少量于A、B试管中 | 固体完全溶解,得到无色透明溶液 | / |
| 步骤二:取试管A,向溶液中加入 |
假设1 或假设3成立;若没有该现象则假设2成立. | |
| 步骤三:取试管B,向其中先加入 再加入 |
产生 再加入试剂看到产生白色沉淀. |
假设3成立.若无白色沉淀产生则假设1成立. |
分析:Ⅰ、根据检验O2的方法;
Ⅱ、根据二氧化硫和碱石灰的性质分析;
Ⅲ、假设分析判断可能是硫酸钠和亚硫酸钠;
(1)假设1是过氧化钠和二氧化硫反应生成硫酸钠,注意过氧化钠有强氧化性;
(2)①根据亚硫酸钠和盐酸反应生成有刺激性气味的气体的性质分析亚硫酸钠的存在;
②根据亚硫酸钠和盐酸反应生成有刺激性气味的气体的性质分析亚硫酸钠的存在,依据酸溶后的溶液中加入氯化钡溶液反应生成白色沉淀的性质分析硫酸钠的存在.
Ⅱ、根据二氧化硫和碱石灰的性质分析;
Ⅲ、假设分析判断可能是硫酸钠和亚硫酸钠;
(1)假设1是过氧化钠和二氧化硫反应生成硫酸钠,注意过氧化钠有强氧化性;
(2)①根据亚硫酸钠和盐酸反应生成有刺激性气味的气体的性质分析亚硫酸钠的存在;
②根据亚硫酸钠和盐酸反应生成有刺激性气味的气体的性质分析亚硫酸钠的存在,依据酸溶后的溶液中加入氯化钡溶液反应生成白色沉淀的性质分析硫酸钠的存在.
解答:解:I.氧气的检验方法是:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有,
故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成;
II.二氧化硫有毒,不能直接排空,二氧化硫是酸性氧化物能和碱性物质反应,所以用碱石灰吸收二氧化硫防止污染空气,
故答案为:吸收二氧化硫尾气,防止污染;
III.假设分析判断可能是硫酸钠和亚硫酸钠,故答案为:即有Na2SO3 又有Na2SO4;
(1)过氧化钠有强氧化性,二氧化硫有还原性,所以过氧化钠和二氧化硫能发生氧化还原反应生成硫酸钠,
故答案为:Na2O2+SO2=Na2SO4;
(2)步骤一、二、取少量C中固体产物于试管中,加入适量的蒸馏水溶解,分别取少量于A、B试管中,固体完全溶解,得到无色透明溶液,取试管A,向溶液中加入4mol/L盐酸振荡,有气泡产生证明含有亚硫酸钠,假设1 或假设3成立;若没有该现象则假设2成立,
故答案为:4mol/L盐酸,有气泡产生;
步骤三、取试管B,向其中先加入4mol/L盐酸,再加入氯化钡溶液,生成刺激性气味的气体,再加入氯化钡出现白色沉淀,假设3成立.若无白色沉淀产生则假设1成立,故答案为:4mol/L盐酸,氯化钡溶液,生成刺激性气味的气体.
故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成;
II.二氧化硫有毒,不能直接排空,二氧化硫是酸性氧化物能和碱性物质反应,所以用碱石灰吸收二氧化硫防止污染空气,
故答案为:吸收二氧化硫尾气,防止污染;
III.假设分析判断可能是硫酸钠和亚硫酸钠,故答案为:即有Na2SO3 又有Na2SO4;
(1)过氧化钠有强氧化性,二氧化硫有还原性,所以过氧化钠和二氧化硫能发生氧化还原反应生成硫酸钠,
故答案为:Na2O2+SO2=Na2SO4;
(2)步骤一、二、取少量C中固体产物于试管中,加入适量的蒸馏水溶解,分别取少量于A、B试管中,固体完全溶解,得到无色透明溶液,取试管A,向溶液中加入4mol/L盐酸振荡,有气泡产生证明含有亚硫酸钠,假设1 或假设3成立;若没有该现象则假设2成立,
故答案为:4mol/L盐酸,有气泡产生;
步骤三、取试管B,向其中先加入4mol/L盐酸,再加入氯化钡溶液,生成刺激性气味的气体,再加入氯化钡出现白色沉淀,假设3成立.若无白色沉淀产生则假设1成立,故答案为:4mol/L盐酸,氯化钡溶液,生成刺激性气味的气体.
点评:本题考查了实验验证物质性质的分析判断,物质的检验和物质性质是解题关键,难度不大,根据题中给予信息分析问题、解决问题.

练习册系列答案
相关题目
(16分)某同学想通过下图装置实验、探究SO2与Na2O2反应的产物。
(夹持装置已略去,装置的气密性良好)

Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)
。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是
。
Ⅱ.某同学想通过上图实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
① 先
②再用带火星的木条靠近干燥管口a,观察其是否复燃。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: 。
(1)若假设2成立,写出所发生反应的化学方程式
。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4。
该方案是否合理 (填“是”或“否”)。
(3)设计实验验证假设3的实验步骤如下:
|
实验步骤 |
实验现象 |
|
①滴加入过量的稀盐酸 |
产生剌激性气味气体 |
|
②滴加入适量的BaCl2溶液 |
产生白色沉淀。 |
|
③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
|
若假设3成立,正确的实验操作顺序是




