网址:http://m.1010jiajiao.com/timu_id_4401240[举报]
|
| 1 |
| 2 |
②CO2(g)+C5(s)+2H+(aq)
|
| C | + 3 |
| 1 |
| 2 |
③12
| C | + 3 |
|
下面关于绿色植物利用水和二氧化碳合成葡
萄糖并放出氧气的热化学方程式正确的是( )
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)氯气工业上来源于氯碱工业,氯碱工业的化学方程式为
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol和-283.0 kJ/mol,则该反应的热化学方程式为:_____ _____;
(3)COCl2的分解反应为COCl2(g)
 Cl2(g) + CO(g) △H
= +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
Cl2(g) + CO(g) △H
= +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):

①计算反应在第8 min时的平衡常数K = __________(保留小数点后两位数字)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、 “>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以V(2—3)、 V(5—6)、 V(l2-13)表示]的大小____________;
⑤反应物COCl2在5-6 min和15-16 min时平均反应速率的大小为:V(5-6) > V(15-16),原因是__ _____________。
查看习题详情和答案>>
溶氧分析仪能连续、自动测量水中微量的溶解氧含量,可用于工业锅炉用水,实验室制备除氧水等方面。溶氧分析仪的核心部件是氧传感器,传感器中银做阳极,金做阴极,二电极之间连接一稳定的直流电源,以氯化钾溶液为电解质溶液,电解质溶液与取样水之间有一层氧气可以透过的薄膜,测量金电极上产生的还原电流的大小得出氧气的含量。
⑴ 试写出溶氧分析仪的有关电极反应式
阴极_______________________________,阳极____________________________________
⑵ 请从你写的电极反应式推测影响氧传感器的性能的因素可能有哪些?
在高温下高炉中氧含量的测定可用氧化锆(ZrO2)氧传感器来测定,在氧化锆中加入MgO,Y2O3等立方晶系的氧化物后,在600℃以上高温时成为氧的快离子导体。其导电性能主要源于掺杂晶体中的氧离子空位。下图为氧化锆固体电解质的导电原理。
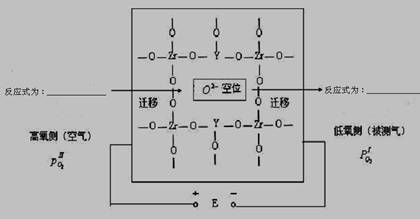
⑶ 写出高氧侧和低氧侧的电极反应式
高氧侧______________________________,低氧侧________________________________
⑷ 若某掺杂电极Y2O3的ZrO2晶体中氧离子空位数为3.01×1020个,则理论上掺杂的Y2O3质量为多少克?
查看习题详情和答案>>全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。
⑴ (2分)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ·mol-1
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ·mol-1
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200 kJ·mol-1
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
。
⑵ (8分)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
v(H2)= mol·(L·min)-1;
② 氢气的转化率= ;
③ 该反应的平衡常数为 (保留小数点后2位);
④ 下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
查看习题详情和答案>>
 从反应开始到平衡,氢气的平均反应速率
从反应开始到平衡,氢气的平均反应速率