��Ŀ����
����(COCl2)�����ϡ��Ƹ��ҩ�ȹ�ҵ����������;����ҵ�ϲ��ø�����CO��Cl2�ڻ���̿���ºϳɡ�
��1��������ҵ����Դ���ȼҵ���ȼҵ�Ļ�ѧ����ʽΪ
��2����ҵ��������Ȼ��(��Ҫ�ɷ�ΪCH4)��CO2���и��������Ʊ�CO��H2����֪CH4��H2��CO��ȼ����(��H)�ֱ�Ϊ��890.3 kJ/mol����285.8kJ/mol�ͣ�283.0 kJ/mol����÷�Ӧ���Ȼ�ѧ����ʽΪ��_____ _____��
��3��COCl2�ķֽⷴӦΪCOCl2(g)
 Cl2(g) + CO(g) ��H
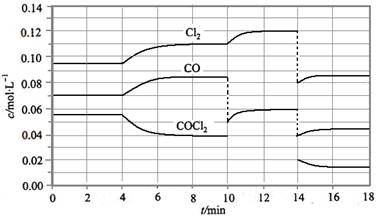
= +108 kJ/mol����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯������ʾ��)��
Cl2(g) + CO(g) ��H
= +108 kJ/mol����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯������ʾ��)��
�ټ��㷴Ӧ�ڵ�8 minʱ��ƽ�ⳣ��K = __________(����С�������λ����)
�ڱȽϵ�2 min��Ӧ�¶�T��2�����8 min��Ӧ�¶�(T8)�ĸߵͣ�T��2��____T��8��(�<���� ��>����=��)��
����12 minʱ��Ӧ���¶�T��8�������´ﵽƽ�⣬���ʱc(COCl2) = ______mol/L��
�ܱȽϲ���CO��2��3 min��5��6 min��12��13 minʱƽ����Ӧ����[ƽ����Ӧ���ʷֱ���V(2��3)�� V(5��6)�� V(l2��13)��ʾ]�Ĵ�С____________��
�ݷ�Ӧ��COCl2��5��6 min��15��16 minʱƽ����Ӧ���ʵĴ�СΪ��V(5��6) > V(15��16)��ԭ����__ _____________��
��1��2NaCl+2H2O 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��2��CH4(g)+CO2(g) ��2CO(g)+2H2(g) ��H=+247.3kJ/mol
��3�� ��0.23 ��< ��0.031 ��V(5��6) > V(2��3)= V(l2��13)
������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ��Ũ��Խ�ߣ���Ӧ����Խ��
��������
�����������1���ȼҵ�ǵ�ⱥ��ʳ��ˮ���Ʊ��������ȼҵ�Ļ�ѧ����ʽΪ2NaCl+2H2O
2NaOH+H2��+Cl2������2�����ݸ�˹���ɣ��ɵ�CH4(g)+CO2(g) ��2CO(g)+2H2(g) ��H=+247.3kJ/mol����3������ͼ��֪��8minʱCOCl2��ƽ��Ũ��Ϊ0.04mol/L��Cl2��ƽ��Ũ��Ϊ0.11mol/L��CO��ƽ��Ũ��Ϊ0.085mol/L���ʸ��¶��»�ѧƽ�ⳣ��k=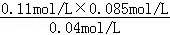 =0.234
mol•L��1���ڵ�8minʱ��Ӧ���Ũ�ȱȵ�2minʱ��С��������Ũ������ƽ��������Ӧ�����ƶ���4min˲��Ũ�Ȳ��䣬������Ϊ�ı�ѹǿ��Ũ�ȣ�Ӧ�Ǹı��¶ȣ�����Ϊ����ӦΪ���ȷ�Ӧ������T��2����T��8�����ʴ�Ϊ����������ͼ��֪��10min˲��Cl2Ũ������CO��Ũ�Ƚ��ͣ��ʸı�����Ϊ����CO������CO��Ũ�ȣ�ƽ�ⳣ�����䣬��8min����ƽ��ʱ��ƽ�ⳣ����ͬ����ͼ��֪��12minʱ����ƽ��ʱCl2��ƽ��Ũ��Ϊ0.12mol/L��CO��ƽ��Ũ��Ϊ0.06mol/L���ʣ�
=0.234
mol•L��1���ڵ�8minʱ��Ӧ���Ũ�ȱȵ�2minʱ��С��������Ũ������ƽ��������Ӧ�����ƶ���4min˲��Ũ�Ȳ��䣬������Ϊ�ı�ѹǿ��Ũ�ȣ�Ӧ�Ǹı��¶ȣ�����Ϊ����ӦΪ���ȷ�Ӧ������T��2����T��8�����ʴ�Ϊ����������ͼ��֪��10min˲��Cl2Ũ������CO��Ũ�Ƚ��ͣ��ʸı�����Ϊ����CO������CO��Ũ�ȣ�ƽ�ⳣ�����䣬��8min����ƽ��ʱ��ƽ�ⳣ����ͬ����ͼ��֪��12minʱ����ƽ��ʱCl2��ƽ��Ũ��Ϊ0.12mol/L��CO��ƽ��Ũ��Ϊ0.06mol/L���ʣ� =0.234mol/L�����c��COCl2��=0.031mol/L���ʴ�Ϊ��0.031������5��6 min��15��16 minʱ��Ӧ�¶���ͬ������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ��Ũ��Խ�ߣ���Ӧ����Խ��15��16 minʱ����ֵ�Ũ�ȶ�С����˷�Ӧ����С����v��5��6����v��15��16����V(5��6) > V(2��3)= V(l2��13)��������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ���Ũ��Խ�ߣ���Ӧ����Խ��
=0.234mol/L�����c��COCl2��=0.031mol/L���ʴ�Ϊ��0.031������5��6 min��15��16 minʱ��Ӧ�¶���ͬ������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ��Ũ��Խ�ߣ���Ӧ����Խ��15��16 minʱ����ֵ�Ũ�ȶ�С����˷�Ӧ����С����v��5��6����v��15��16����V(5��6) > V(2��3)= V(l2��13)��������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ���Ũ��Խ�ߣ���Ӧ����Խ��
���㣺���⿼�黯ѧ����ʽ���Ȼ�ѧ����ʽ����д�ͻ�ѧƽ��ͼ����йؼ��㡣

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�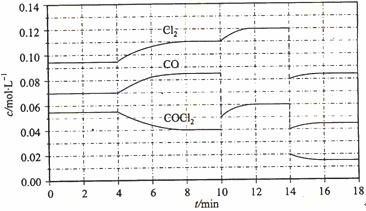
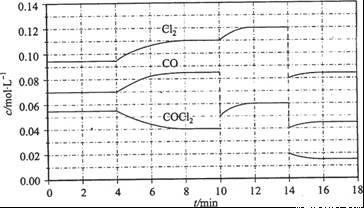
 Cl2(g) + CO(g)����H =" +" 108 KJ��mol-1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״�����ͼ��ÿ�ν��ı�һ����������
Cl2(g) + CO(g)����H =" +" 108 KJ��mol-1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״�����ͼ��ÿ�ν��ı�һ����������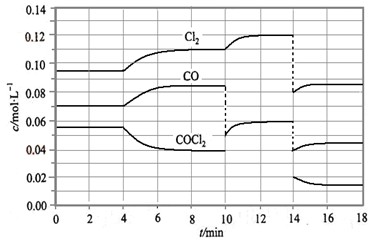

 Cl2(g) + CO(g)�� ��H = + 108 KJ��mol-1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14
min��COCl2Ũ�ȱ仯����δ����)��
Cl2(g) + CO(g)�� ��H = + 108 KJ��mol-1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14
min��COCl2Ũ�ȱ仯����δ����)��