网址:http://m.1010jiajiao.com/timu_id_438667[举报]
第I卷(选择题,共48分)
一、选择题(共48分,每小题2 分,共24小题,每小题只有一个正确答案)
13 D 14 D
第II卷(非选择题,共52 分)
二、填空题(共23个空,每空2分,共46分)
25. CO2 NH3 CO2
26. ⑴ ②④ ;⑵ ①⑥; ⑶ ⑤
27.氧化剂 酸性 还原剂,酸性
28.不褪色 SO2 + Cl2 + 2H2O = 2HCl + H2SO4
29. H+ + HCO3― = H2O+ CO2↑
CO2 + 2OH― = H2O + CO32―
CO2 + CO32― + H2O = 2HCO3―
 30.(1) A:BaCl2 B:FeSO
30.(1) A:BaCl2 B:FeSO
(2) FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4, 4 Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(3)Al3+ + 3OH- = Al(OH)3↓, Al(OH)3 + OH- = AlO2- + 2H2O
三、计算题(写出必要的计算过程。6分)
31.解:设原NaNO3溶液的质量为x,则22%x=(100+x)14%,解得x=
所以,m(NaNO3) =
c(NaNO3) = n(NaNO3)/V(aq)
= 3.02mol/L …………………………………………… ……... 3分
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
生态循环的无毒气体,并促进二氧化硫的转化.
(1)汽车尾气中导致酸雨形成的主要物质是
(2)写出在催化剂的作用下CO跟NO反应的化学方程式
| ||
| ||
(3)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是
(4)下列各项措施中,有利于缓解城市空气污染的有
A.充分利用太阳能,减少能源消耗 B.使用电动车辆,减少汽油消耗
C.植树种草,绿化环境 D.取缔燃煤炉和木炭烧烤,改用天然气.
汽车尾气(含CO、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气
生态循环的无毒气体,并促进二氧化硫的转化.
(1)汽车尾气中导致酸雨形成的主要物质是______.
(2)写出在催化剂的作用下CO跟NO反应的化学方程式______.
(3)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是______.
(4)下列各项措施中,有利于缓解城市空气污染的有______(填序号)
A.充分利用太阳能,减少能源消耗 B.使用电动车辆,减少汽油消耗
C.植树种草,绿化环境 D.取缔燃煤炉和木炭烧烤,改用天然气.
查看习题详情和答案>>
生态循环的无毒气体,并促进二氧化硫的转化.
(1)汽车尾气中导致酸雨形成的主要物质是______.
(2)写出在催化剂的作用下CO跟NO反应的化学方程式______.
(3)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是______.
(4)下列各项措施中,有利于缓解城市空气污染的有______(填序号)
A.充分利用太阳能,减少能源消耗 B.使用电动车辆,减少汽油消耗
C.植树种草,绿化环境 D.取缔燃煤炉和木炭烧烤,改用天然气.
(1)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应.下列有关说法正确的是______.
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=______;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率______50%(选填“>”、“<”或“=”).
(3)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如图:

用臭氧消毒自来水,适宜的条件是______.
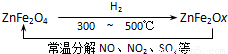
(4)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
若2mol ZnFe2Ox与SO2可生成0.75mol S,x=______.
 查看习题详情和答案>>
查看习题详情和答案>>