题目内容
二氧化硫和氮的氧化物是大气的主要污染物,关注臭氧层、防止和治理环境污染是当前环保工作的重要研究内容之一.(1)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应.下列有关说法正确的是______.
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=______;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率______50%(选填“>”、“<”或“=”).
(3)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如图:

用臭氧消毒自来水,适宜的条件是______.
(4)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
若2mol ZnFe2Ox与SO2可生成0.75mol S,x=______.

【答案】分析:(1)A、在对流层相当稳定的氟利昂,在上升进入平流层后,在一定的气象条件下,会在强烈紫外线的作用下被分解,分解释放出的氯原子同臭氧会发生连锁反应,不断破坏臭氧分子;
B、氮氧化物(NOx)主要是指NO和NO2.NO和NO2都是对人体有害的气体.氮氧化物和碳氢化合物(HC)在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物----光化学烟雾,在这种复杂的光化学反应过程中,主要生成光化学氧化剂(主要是O3)及其他多种复杂的化合物,统称光化学烟雾;
C、臭氧具有强氧化性分析判断;
D、臭氧具有强氧化性能氧化碘离子为单质碘,与淀粉变蓝色;
(2)依据化学平衡的三段式列式计算平衡浓度,结合平衡常数概念计算;依据化学平衡的影响因素和移动原理分析判断;
(3)依据图象曲线变化结合纵轴和横轴意义分析变化规律,臭氧分解越快,氧化能力越强;
(4)依据氧化还原反应的电子守恒和化合物中的元素化合价代数为0计算得到.
解答:解:(1)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应;
A.停止使用氟里昂是为保护臭氧层,因为氟利昂分解释放出的氯原子同臭氧会发生连锁反应,不断破坏臭氧分子,故A符合;
B.光化学烟雾主要生成光化学氧化剂(主要是O3)及其他多种复杂的化合物,与大气臭氧的生成有关,故B符合;
C.家用电器消毒柜中产生的臭氧具有强氧化性,能够高效杀菌消毒,故C符合;
D.臭氧能把湿润的碘化钾-淀粉试纸中的碘离子氧化为碘单质,遇淀粉变蓝,故D符合;
故选ABCD;
故答案为:ABCD;
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,列出化学平衡的三段式计算:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=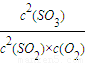 =
=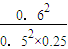 =5.76;
=5.76;
若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%;故答案为:5.76;<;
(3)依据图象中曲线变化分析,溶解度随温度升高减小,中性溶液中臭氧浓度温度越低变化越小,分解速率在中性或弱碱性溶液中分解越快;用臭氧消毒自来水,适宜的条件是:低温,水的pH控制7或弱碱性;
故答案为:低温,水的pH控制7或弱碱性;
(4)新型纳米材料ZnFe2Ox可由化合物ZnFe2O4经高温还原制得,若2mol ZnFe2O x与SO2反应可生成0.75molS,则ZnFe2O x被还原为ZnFe2O4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.75mol×4,解得,a=2.25,利用化合价代数和为,2+2.25×2=2x,解得x=3.25;故答案为:3.25.
点评:本题考查了臭氧的性质分析判断,对环境的影响,化学平衡的三段式计算应用,平衡常数的概念应用,图象分析判断,物质组成的计算应用,题目难度较大.
B、氮氧化物(NOx)主要是指NO和NO2.NO和NO2都是对人体有害的气体.氮氧化物和碳氢化合物(HC)在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物----光化学烟雾,在这种复杂的光化学反应过程中,主要生成光化学氧化剂(主要是O3)及其他多种复杂的化合物,统称光化学烟雾;
C、臭氧具有强氧化性分析判断;
D、臭氧具有强氧化性能氧化碘离子为单质碘,与淀粉变蓝色;
(2)依据化学平衡的三段式列式计算平衡浓度,结合平衡常数概念计算;依据化学平衡的影响因素和移动原理分析判断;
(3)依据图象曲线变化结合纵轴和横轴意义分析变化规律,臭氧分解越快,氧化能力越强;
(4)依据氧化还原反应的电子守恒和化合物中的元素化合价代数为0计算得到.
解答:解:(1)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应;
A.停止使用氟里昂是为保护臭氧层,因为氟利昂分解释放出的氯原子同臭氧会发生连锁反应,不断破坏臭氧分子,故A符合;
B.光化学烟雾主要生成光化学氧化剂(主要是O3)及其他多种复杂的化合物,与大气臭氧的生成有关,故B符合;
C.家用电器消毒柜中产生的臭氧具有强氧化性,能够高效杀菌消毒,故C符合;
D.臭氧能把湿润的碘化钾-淀粉试纸中的碘离子氧化为碘单质,遇淀粉变蓝,故D符合;
故选ABCD;
故答案为:ABCD;
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,列出化学平衡的三段式计算:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=
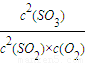 =
=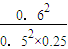 =5.76;
=5.76;若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%;故答案为:5.76;<;
(3)依据图象中曲线变化分析,溶解度随温度升高减小,中性溶液中臭氧浓度温度越低变化越小,分解速率在中性或弱碱性溶液中分解越快;用臭氧消毒自来水,适宜的条件是:低温,水的pH控制7或弱碱性;
故答案为:低温,水的pH控制7或弱碱性;
(4)新型纳米材料ZnFe2Ox可由化合物ZnFe2O4经高温还原制得,若2mol ZnFe2O x与SO2反应可生成0.75molS,则ZnFe2O x被还原为ZnFe2O4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.75mol×4,解得,a=2.25,利用化合价代数和为,2+2.25×2=2x,解得x=3.25;故答案为:3.25.
点评:本题考查了臭氧的性质分析判断,对环境的影响,化学平衡的三段式计算应用,平衡常数的概念应用,图象分析判断,物质组成的计算应用,题目难度较大.

练习册系列答案
相关题目
 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.



 (2009?抚顺模拟)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(2009?抚顺模拟)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.