摘要:从以上分析可知:第一次和第二次加入20g氢氧化钠溶液后反应铝的质量均为5.4g,而第三次加入20 g氢氧化钠溶液后反应铝的质量只有1.2 g.说明第三次加入的20g氢氧化钠溶液过量.铝已完全反应.剩余的固体是不参加反应的镁.其质量为4.0 g.则16 g镁铝合金中铝的质量为16g-4.0 g=12.0 g,故镁铝合金中镁元素与铝元素的质量比为4.0 g:12.0 g=1:3.计算氢氧化钠溶液中溶质的质量分数时.要以氢氧化钠全部参加反应为计算依据.如第一次和第二次.设氢氧化钠溶液中溶质的质量分数为x 2Al + 2NaOH + 2H2O====2NaAlO2 + 3H2↑ 54 80
网址:http://m.1010jiajiao.com/timu_id_435584[举报]
化学物质之间的反应奥妙无穷.在一次化学探究活动中,同学们从不同角度对稀硫酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白.
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
①请你分析上述方案中为什么强调只有测得的PH≥7才能证明反应发生了?
②写出稀硫酸与氢氧化钠溶液反应的化学方程式
(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
(3)探究稀硫酸与氢氧化钠溶液是否恰好完全反应
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
此时有同学提出方案二不能证明稀硫酸与氢氧化钠溶液恰好完全反应,其原因是
能力提升:
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)).
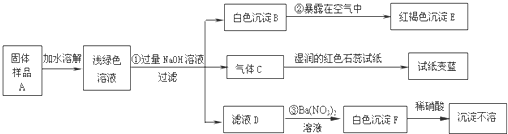
试回答下列问题:
(1)写出下列物质的化学式:C
(2)写出下列变化的化学方程式:
②
(3)上述探究结果说明样品A中含有的离子有
查看习题详情和答案>>
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 |
稀硫酸与氢氧化钠溶液能发生反应 |
排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大
排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大
或只有PH≥7才能说明硫酸已经反应掉了
或只有PH≥7才能说明硫酸已经反应掉了
.②写出稀硫酸与氢氧化钠溶液反应的化学方程式
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若 生成蓝色沉淀 生成蓝色沉淀 |
氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);
若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);
.为此,还需要选择紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等).
紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等).
(填一种试剂),再进行实验即可.能力提升:
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)).

试回答下列问题:
(1)写出下列物质的化学式:C
NH3
NH3
、EFe(OH)3
Fe(OH)3
、FBaSO4
BaSO4
(2)写出下列变化的化学方程式:
②
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
③Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
(3)上述探究结果说明样品A中含有的离子有
Fe2+、NH4+、SO42-
Fe2+、NH4+、SO42-
.化学物质之间的反应奥妙无穷.在一次化学探究活动中,同学们从不同角度对稀硫酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白.
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 | 稀硫酸与氢氧化钠溶液能发生反应 |
______.
②写出稀硫酸与氢氧化钠溶液反应的化学方程式______.
(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若______ | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
能力提升:
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)).
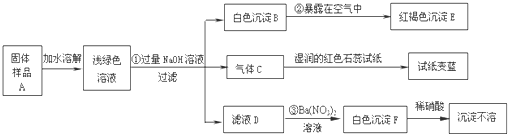
试回答下列问题:
(1)写出下列物质的化学式:C______、E______、F______
(2)写出下列变化的化学方程式:
②______ ③______
(3)上述探究结果说明样品A中含有的离子有______. 查看习题详情和答案>>
碱式碳酸铜是一种绿色的固体,受热分解成黑色固体物质、二氧化碳和水.这种黑色固体的成分是什么呢?亮亮与间学们进行以下探究:
[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
接着小明与同学们用氢气还原氧化铜制取铜.
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O 查看习题详情和答案>>
[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O 查看习题详情和答案>>
碱式碳酸铜是一种绿色的固体,受热分解成黑色固体物质、二氧化碳和水.这种黑色固体的成分是什么呢?亮亮与间学们进行以下探究:
[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
接着小明与同学们用氢气还原氧化铜制取铜.
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O 查看习题详情和答案>>
[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O 查看习题详情和答案>>
2010年5月12日,在苍茫海水中沉没了800多年的“南海一号”重见天日,其中的宋代铜钱已经锈迹斑斑。已知:铜绿的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它受热分解的化学方程式为:某同学设计了如下实验,用来测定碱式碳酸铜受热分解后产生的水和二氧化碳的质量比。![]()
实验用到的主要装置为: 装置连接顺序为: 。(填写编号)

(2)操作步骤及数据处理:
第一步 检查气密性;
第二步 装入药品,称取装置①和③的质量;
第三步 试验后再次称取装置①和③的质量,记录数据如下;
根据以上数据可得产生的水和二氧化碳的质量之比为 。(要求写出最简整数比)
(3)结果分析;从下列选项中选出产生该实验结果可能的原因有哪些?
A.二氧化碳没有被完全吸收 B.水没有被完全吸收 C.碱式碳酸铜药品中含有水分 D.碱式碳酸铜没有完全分解
