题目内容
碱式碳酸铜是一种绿色的固体,受热分解成黑色固体物质、二氧化碳和水.这种黑色固体的成分是什么呢?亮亮与间学们进行以下探究:[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O
【答案】分析:[设计实验]因为固体全部溶解可判断该固体是氧化铜,与硫酸反应会生成硫酸铜的蓝色溶液;
(1)从金属活动性顺序以及酸的性质分析判断;
(2)氢气是可燃性气体不能与氧气或空气混合否则点燃火加热时易发生爆炸;
(3)①利用4.0g氧化铜中铜元素的质量,结合元素守恒的知识判断红色物质的成分即可;
②依据氧化铜能与稀硫酸反应生成蓝色溶液进行分析探讨即可;
③类比氢气还原氧化铜的反应方程式对氢气还原氧化亚铜的方程式进行书写即可;
解答:解:[设计实验]因为碳不能与稀硫酸反应,所以固体全部溶解可判断该固体是氧化铜,氧化铜与硫酸反应会生成硫酸铜和水并形成蓝色溶液;
(1)铁的活动性较弱制取氢气较慢,镁的活动性较强制取氢气速度较快,浓盐酸易挥发会导致制取的氢气不纯,只有锌与稀硫酸制取的氢气较纯净且速度适宜实验;
(2)氢气是可燃性气体不能与氧气或空气混合否则点燃火加热时易发生爆炸,所以实验开始时,应先通入一会儿氢气以排净装置内的空气,防止爆炸的产生;
(3)①利用化学式的计算可知4.0g氧化铜中铜元素的质量等于4.0g×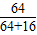 =3.2g,依据元素守恒的知识可判断红色物质的成分中含有的铜的质量也应是3.2g,所以第二次生成的红色物质是铜,第一次有氧化亚铜生成;
=3.2g,依据元素守恒的知识可判断红色物质的成分中含有的铜的质量也应是3.2g,所以第二次生成的红色物质是铜,第一次有氧化亚铜生成;
②因为氧化铜能与稀硫酸反应可生成蓝色的硫酸铜溶液而氧化亚铜不能,所以用产物与稀硫酸反应可判断分析结果的准确性;
③类比氢气还原氧化铜的反应方程式对氢气还原氧化亚铜的方程式是:2CuO+H2 Cu2O+H2O;
Cu2O+H2O;
故答案为:(1)蓝色; CuO+H2SO4═CuSO4+H2O
(1)D
(2)H2;防止加热时发生爆炸
(3)①4gCuO中含有的铜元素质量为3.2g,所以生成铜的质量为3.2g.
②分别取两种红色固体于试管中,加入稀硫酸,第一次试管中溶液不变蓝,第二次试管中溶液变蓝.
③2CuO+H2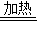 Cu2O+H2O
Cu2O+H2O
点评:在研究物质组成时,通过定性的探究实验不能确定某组成成分时,可通过定量研究加以判断;定量研究时,质量守恒思想是进行推断的根本依据.
(1)从金属活动性顺序以及酸的性质分析判断;
(2)氢气是可燃性气体不能与氧气或空气混合否则点燃火加热时易发生爆炸;
(3)①利用4.0g氧化铜中铜元素的质量,结合元素守恒的知识判断红色物质的成分即可;
②依据氧化铜能与稀硫酸反应生成蓝色溶液进行分析探讨即可;
③类比氢气还原氧化铜的反应方程式对氢气还原氧化亚铜的方程式进行书写即可;
解答:解:[设计实验]因为碳不能与稀硫酸反应,所以固体全部溶解可判断该固体是氧化铜,氧化铜与硫酸反应会生成硫酸铜和水并形成蓝色溶液;
(1)铁的活动性较弱制取氢气较慢,镁的活动性较强制取氢气速度较快,浓盐酸易挥发会导致制取的氢气不纯,只有锌与稀硫酸制取的氢气较纯净且速度适宜实验;
(2)氢气是可燃性气体不能与氧气或空气混合否则点燃火加热时易发生爆炸,所以实验开始时,应先通入一会儿氢气以排净装置内的空气,防止爆炸的产生;
(3)①利用化学式的计算可知4.0g氧化铜中铜元素的质量等于4.0g×
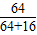 =3.2g,依据元素守恒的知识可判断红色物质的成分中含有的铜的质量也应是3.2g,所以第二次生成的红色物质是铜,第一次有氧化亚铜生成;
=3.2g,依据元素守恒的知识可判断红色物质的成分中含有的铜的质量也应是3.2g,所以第二次生成的红色物质是铜,第一次有氧化亚铜生成;②因为氧化铜能与稀硫酸反应可生成蓝色的硫酸铜溶液而氧化亚铜不能,所以用产物与稀硫酸反应可判断分析结果的准确性;
③类比氢气还原氧化铜的反应方程式对氢气还原氧化亚铜的方程式是:2CuO+H2
 Cu2O+H2O;
Cu2O+H2O;故答案为:(1)蓝色; CuO+H2SO4═CuSO4+H2O
(1)D
(2)H2;防止加热时发生爆炸
(3)①4gCuO中含有的铜元素质量为3.2g,所以生成铜的质量为3.2g.
②分别取两种红色固体于试管中,加入稀硫酸,第一次试管中溶液不变蓝,第二次试管中溶液变蓝.
③2CuO+H2
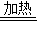 Cu2O+H2O
Cu2O+H2O点评:在研究物质组成时,通过定性的探究实验不能确定某组成成分时,可通过定量研究加以判断;定量研究时,质量守恒思想是进行推断的根本依据.

练习册系列答案
相关题目
 (2012?烟台)2012年3月6日,包括圆明园兽首在内的一批珍贵文物首次在烟台展出.小霞看到这些240年前的铜质兽首后,她想探究铜是怎么冶炼出来的.
(2012?烟台)2012年3月6日,包括圆明园兽首在内的一批珍贵文物首次在烟台展出.小霞看到这些240年前的铜质兽首后,她想探究铜是怎么冶炼出来的.