摘要:1.A:NH4NO3 C:Mg3N2 E:NH3
网址:http://m.1010jiajiao.com/timu_id_433739[举报]
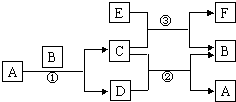 图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质.反应①②是置换反应,反应①②③均在高温下进行.A在常温下为液态,C有磁性,E与强碱溶液反应可产生H2,F是既能溶于NaOH又能溶于HCl的氧化物.
图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质.反应①②是置换反应,反应①②③均在高温下进行.A在常温下为液态,C有磁性,E与强碱溶液反应可产生H2,F是既能溶于NaOH又能溶于HCl的氧化物.(1)A的化学式
(2)写出反应①的化学方程式
(3)写出E与浓强碱液反应的离子方程式
(4)C、E的混合物在工业上用于钢轨焊接(高温下置换出熔化状态的铁可用于焊接),写出反应③的化学方程式:
下表是元素周期表的一部分,回答下列有关问题:
(1)g的离子结构示意图
 ,k的元素名称是
,k的元素名称是
(2)上述元素最高价氧化物对应的水化物中,最强酸的化学式是
(3)上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,该物质的电离方程式为
(4)从原子结构角度解释c的金属性强于d的原因是:
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | ||
| 4 | J | k |


溴
溴
.a与f可以形成一种硬度大、耐高温的陶瓷材料,该物质的化学式是Si3N4
Si3N4
.(2)上述元素最高价氧化物对应的水化物中,最强酸的化学式是
HClO4
HClO4
,最强碱与两性氢氧化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O
Al(OH)3+KOH=KAlO2+2H2O
.(3)上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,该物质的电离方程式为
NaF=Na++F-
NaF=Na++F-
;已知常温下该物质的水溶液显碱性,其原因是F-+H2O?HF+OH-
F-+H2O?HF+OH-
(用离子方程式表示).(4)从原子结构角度解释c的金属性强于d的原因是:
二者电子层数相同,但钠原子半径大于镁原子,所以钠原子更易失电子
二者电子层数相同,但钠原子半径大于镁原子,所以钠原子更易失电子
.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)表中b
(2)20s时,N2O4的浓度为
(3)在80℃时该反应的平衡常数K=
(写表达式).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.
查看习题详情和答案>>
| C(mol/L)时间(s) | O | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)表中b
>
>
c(填“<”、“=”、“>”).(2)20s时,N2O4的浓度为
0.14
0.14
mol/L,0--20s内N2O4的平均反应速率为0.003mol/(L.s)
0.003mol/(L.s)
.(3)在80℃时该反应的平衡常数K=
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
ABD
ABD
.A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:| n(mol) 时间(s) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
0.4mol
0.4mol
,e=0.1mol
0.1mol
(2)20s-40s内用N2O4表示的平均反应速率为
0.002mol/(L?S)
0.002mol/(L?S)
_;80℃该反应的化学平衡常数K为1.8mol?L-1
1.8mol?L-1
.(3)改变条件达到新平衡,要使NO2在平衡体系中体积分数变小,采取的措施有
AD
AD
.A.向混合气体中再通入N2O4 B.保持容积不变,通入He C.使用高效催化剂 D.降低温度
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应.则达到平衡时n(NO2)
大于
大于
0.60mol(填“大于”“等于”或“小于”)(5)如图是80℃时容器中N2O4物质的量的变化曲线,该图中补画出该反应在60℃时N2O4物质的量的变化曲线.
(2010?天河区一模)下表为元素周期表的一部分,请参照元素A-H在表中的位置,用化学用语回答下列问题:
(1)上述元素中非金属性最强的元素是
(2)B、C、H的最高价含氧酸的酸性由强到弱的顺序是
(3)上述一元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物化合物Z、M,回答下列问题:
①写出物质X的电子式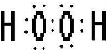
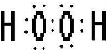 ;
;
②写出Z与Y反应的化学方程式
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | |||||
F
F
,金属性最强的是Na
Na
.(2)B、C、H的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.D、E、F的原子半径由大到小的顺序为Na>O>F
Na>O>F
.(3)上述一元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
;(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物化合物Z、M,回答下列问题:
①写出物质X的电子式
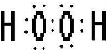
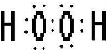
②写出Z与Y反应的化学方程式
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.