题目内容
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:| n(mol) 时间(s) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)20s-40s内用N2O4表示的平均反应速率为
(3)改变条件达到新平衡,要使NO2在平衡体系中体积分数变小,采取的措施有
A.向混合气体中再通入N2O4 B.保持容积不变,通入He C.使用高效催化剂 D.降低温度
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应.则达到平衡时n(NO2)
(5)如图是80℃时容器中N2O4物质的量的变化曲线,该图中补画出该反应在60℃时N2O4物质的量的变化曲线.
100s时△n(N2O4)=
| 1 |
| 2 |
(2)先根据二氧化氮物质的量计算20s反应的四氧化二氮的物质的量,进而计算20s容器内四氧化二氮的物质的量,在计算20s~40s参加反应的四氧化二氮的物质的量,再根据速率定义式计算四氧化二氮的平均反应速率;
反应的平衡常数为生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,由表中数据可知80s时,反应达平衡状态,计算出平衡时反应混合物各组分的物质的量,进而计算平衡时各组分的浓度,代入平衡常数表达式计算;
(3)NO2在平衡体系中体积分数变小,应使平衡向逆反应方向移.
A.向混合气体中再通入N2O4,平衡向正反应移动,最终的平衡状态,等效为增大压强到达平衡状态;
B.保持容积不变,通入He,反应混合物的浓度不变,平衡不移动;
C.使用高效催化剂,缩短到达平衡的水解,但平衡不移动;
D.降低温度平衡向逆反应移动;
(4)该反应是气体物质的量增大的反应,维持压强不变,等效为降低压强,平衡向正反应移动,四氧化二氮的转化率增大;
(5)降低温度反应速率降低,到达平衡的时间比80℃时长,平衡逆反应移动,平衡时N2O4的物质的量较80℃时大,以此画图.
100s时△n(NO2)=0.6mol,所以△n(N2O4)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.4mol;0.1mol;
(2)20s时△n(NO2)=0.24mol,故△n(N2O4)=
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 40s-20s |
由表中数据可知80s时,反应达平衡状态,由(1)中计算可知d=e=0.1mol,故c(N2O4)=
| 0.1mol |
| 2L |
| 0.6mol |
| 2L |
| 0.32 |
| 0.05 |
(3)A.向混合气体中再通入N2O4,平衡向正反应移动,最终的平衡状态,等效为增大压强到达平衡状态,增大压强平衡向逆反应移动,NO2在平衡体系中体积分数变小,故A正确;
B.保持容积不变,通入He,反应混合物的浓度不变,平衡不移动,NO2在平衡体系中体积分数不变,故B错误;
C.使用高效催化剂,缩短到达平衡的水解,但平衡不移动,NO2在平衡体系中体积分数不变,故C错误;
D.降低温度平衡向逆反应移动,NO2在平衡体系中体积分数减小,故D错误;
故选:AD;
(4)该反应是气体物质的量增大的反应,维持压强不变,等效为降低压强,平衡向正反应移动,四氧化二氮的转化率增大,则达到平衡时n(NO2)大于0.60mol,故答案为:大于;
(5)降低温度反应速率降低,到达平衡的时间比80℃时增大,平衡逆反应移动,平衡时N2O4的物质的量较80℃时大,故该反应在60℃时N2O4物质的量的变化曲线为:
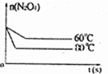 ,故答案为:
,故答案为: .
.
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
(14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g) 2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
|
| 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)求b、e的值:b= ,e=
(2)计算20s—40s内用N2O4表示的平均反应速率为 ;80℃该反应的化学平衡常数K为
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号) 。
A.向混合气体中再通入N2O4 B.保持容积不变,通入He
C.使用高效催化剂 D.降低温度
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。