网址:http://m.1010jiajiao.com/timu_id_433681[举报]
(14分)
A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示: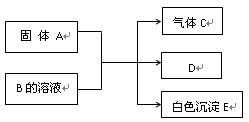
(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是 ;工业上冶炼A的化学反应方程式是 。
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是 ;1 mol C完全燃烧生成液态水时放热1300 kJ·mol-1,则C完全燃烧的热化 学方程式是 。A与盐B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是 。
学方程式是 。A与盐B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是 。
A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
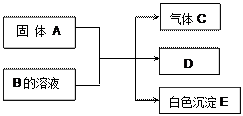 |
(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是 ;工业上冶炼A的化学反应方程式是 。
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是 ;1 mol C完全燃烧生成液态水时放热1300 kJ·mol-1,则C完全燃烧的热化学方程式是 。A与B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是 。 查看习题详情和答案>>
A、B、C、D是元素周期表前四周期常见的四种元素,原子序数依次增大, 它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
|
元素 相关结构和性质 A A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 B 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 C 其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 D D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
(1)D位于元素周期表第 周期第 族,其基态原子核外价电子排布式为 ;元素D的高价氯化物形成的盐溶液刻蚀印刷电路板电路所发生反应 的离子方程式为 ;
(2)钠与B元素形成的Na3B晶体属于 晶体(填“分子”、“原子”、“离子”)。 分析B元素的气态氢化物极易溶于水的原因,除了因为它们均是极性分子之外,还因为 ;
(3)元素A与元素B相比,非金属性较强的是 (用元素符号表示),可以作为判断两者非金属性强弱的依据的是 。
a.常温下A的单质和B的单质状态不同
b.该两种原子形成的共价键中共用电子对的偏向
c.最高价氧化物对应水化物的酸性强弱
d.单质与酸反应的难易程度
(4)已知毎5.4g元素C的单质可与元素D的低价氧化物反应,放出346.2kJ的热量。试写出该反应的热化学方程式: 。
查看习题详情和答案>>