摘要:A
网址:http://m.1010jiajiao.com/timu_id_428350[举报]
氯化亚铜在工业上应用广泛.氯化亚铜(CuC1)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.
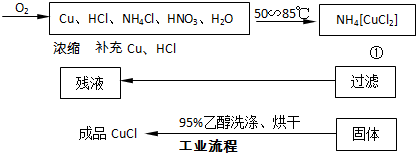
实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为
(2)工业化生产时,95%乙醇可通过
(3)实验室用右图装置制备CuC1.
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择

②实验开始时,温度计显示反应液温度低于室温,主要原因是
查看习题详情和答案>>

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为
NH4[CuCl2]=CuCl↓+NH4Cl
NH4[CuCl2]=CuCl↓+NH4Cl
,用95%乙醇代替蒸馏水洗涤的主要目的是避免CuCl溶于水而造成损耗或洗去晶体表面的杂质离子及水份
避免CuCl溶于水而造成损耗或洗去晶体表面的杂质离子及水份
.(2)工业化生产时,95%乙醇可通过
蒸馏
蒸馏
方法回收并循环利用,而NH4Cl、HNO3
HNO3
(填化学式)可直接循环利用.
(3)实验室用右图装置制备CuC1.
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择
B
B
装置(填字母序号A、B、C).
②实验开始时,温度计显示反应液温度低于室温,主要原因是
氯化铵溶于水吸收大量热量,造成反应液温度降低
氯化铵溶于水吸收大量热量,造成反应液温度降低
;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当烧瓶上方红棕色气体逐渐变为无色
烧瓶上方红棕色气体逐渐变为无色
_时才能停止通入氧气,待冷却至室温后,再打开瓶塞,沿a或c
a或c
(填字母a、b、c)口倾出棕色反应液于1000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按如图1所示流程制备氯化铜晶体(CuCl2?2H20).
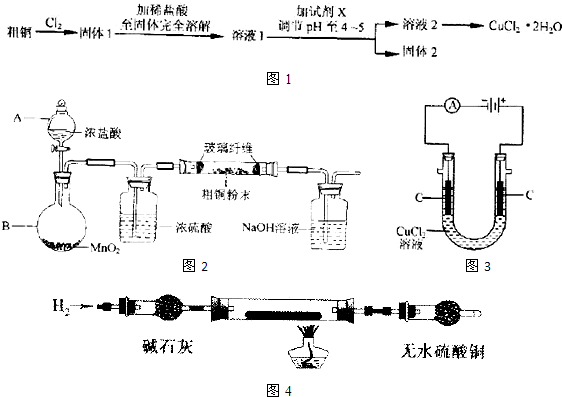
(1)实验室采用如图2所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①装置B中发生反应的离子方程式是
②有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装胃,你认为是否必要
(2)试剂X用以除去杂质,X可选用下列试剂中的
a. NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色出蓝色变为绿色.小组同学欲探究其原因.
己知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)(蓝色)+4Cl-(aq)?CuCl42-(aq)(黄色)+4H2O(l)
①上述反应的化学平衡常数表达式是K=
.若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能证明CuCl2溶液中有上述转化关系的是(填序号)
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入NaCl固体,溶液变为绿色
c.取Y进行电解,溶液颜色最终消失
(4)如图3所示,用石墨电极电解CuCl2溶液,小组同学发现阴极碳棒上有红色和白色两种颜色的固体析出.有关文献资料表明,在铜和铜的化合物中Cu为紫红色,Cu2O为红色,CuCl为白色,它们都不溶于水.
①小组同学将阴极碳棒洗涤干净并干燥后,放入玻璃管中,按如图4所示连接装置.排净装置中的空气后,充分加热,并将一张湿润的蓝色石蕊试纸置于装置末端的导管口附近.实验中发现,碳棒上的白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色.根据上述现象,玻璃管中发生反应的化学方程式为
②电解CuCl2溶液时,阴极发生反应的电极方程式为
查看习题详情和答案>>

(1)实验室采用如图2所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①装置B中发生反应的离子方程式是
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
②有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装胃,你认为是否必要
否
否
(填“是”或“否”).(2)试剂X用以除去杂质,X可选用下列试剂中的
cd
cd
(填序号).a. NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色出蓝色变为绿色.小组同学欲探究其原因.
己知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)(蓝色)+4Cl-(aq)?CuCl42-(aq)(黄色)+4H2O(l)
①上述反应的化学平衡常数表达式是K=
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
不变
不变
.②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能证明CuCl2溶液中有上述转化关系的是(填序号)
abc
abc
.a.将Y稀释,发现溶液呈蓝色
b.在Y中加入NaCl固体,溶液变为绿色
c.取Y进行电解,溶液颜色最终消失
(4)如图3所示,用石墨电极电解CuCl2溶液,小组同学发现阴极碳棒上有红色和白色两种颜色的固体析出.有关文献资料表明,在铜和铜的化合物中Cu为紫红色,Cu2O为红色,CuCl为白色,它们都不溶于水.
①小组同学将阴极碳棒洗涤干净并干燥后,放入玻璃管中,按如图4所示连接装置.排净装置中的空气后,充分加热,并将一张湿润的蓝色石蕊试纸置于装置末端的导管口附近.实验中发现,碳棒上的白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色.根据上述现象,玻璃管中发生反应的化学方程式为
2CuCl+H2
2Cu+2HCl
| ||
2CuCl+H2
2Cu+2HCl
.
| ||
②电解CuCl2溶液时,阴极发生反应的电极方程式为
Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl
Cu2++2e-=Cu;Cu2++Cl-+e-=CuCl
.氯化碘(ICl)的性质类似卤素,有很强的化学活动性.ICl跟Zn、H2O的反应如下:
①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO 下列叙述中正确的是( )
①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO 下列叙述中正确的是( )
查看习题详情和答案>>
氯化铜晶体(CuCl2?xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
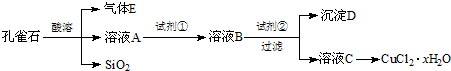
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①选用
A.Cu B.Cl2 C.NH3?H2O D.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是
(3)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是
②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=
(用含a、b的代数式表示).
查看习题详情和答案>>

已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |
B
B
(填字母).A.Cu B.Cl2 C.NH3?H2O D.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是
3.7~5.4
3.7~5.4
.由溶液C获得CuCl2?xH2O,包含4个基本实验操作,这4个基本实验操作依次是蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
过滤和无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是防止CuCl2?xH2O晶体溶解损失
防止CuCl2?xH2O晶体溶解损失
.(3)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是
CuCl2?xH2O晶体加热时会发生水解
CuCl2?xH2O晶体加热时会发生水解
.②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=
| 80a-135b |
| 18b |
| 80a-135b |
| 18b |
(A)针对以下A~D四个涉及H2O2的反应(未配平),填写空白:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2+H2O
C.H2O2→H2O+O2
D. H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是(填代号)
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)
(3)H2O2体现弱酸性的反应是(填代号)
(B)某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式为
(2)装置A的烧瓶中可装试剂
(3)B装置的名称是
(4)通入C装置的两根导管左边较长、右边较短,目的是
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
查看习题详情和答案>>
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2+H2O
C.H2O2→H2O+O2
D. H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是(填代号)
D
D
,该反应配平的化学方程式为3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
.(2)H2O2既体现氧化性又体现还原性的反应是(填代号)
C
C
.(3)H2O2体现弱酸性的反应是(填代号)
A
A
,其理由为这一反应可看作是强酸制取弱酸的反应
这一反应可看作是强酸制取弱酸的反应
.(B)某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(2)装置A的烧瓶中可装试剂
生石灰或固体氢氧化钠
生石灰或固体氢氧化钠
.(3)B装置的名称是
球形干燥管
球形干燥管
;E装置的作用除去氯气中的HCl
除去氯气中的HCl
.(4)通入C装置的两根导管左边较长、右边较短,目的是
使密度大的氯气与密度小的氨气较快地均匀混合
使密度大的氯气与密度小的氨气较快地均匀混合
.(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
3Cl2+8NH3═N2+6NH4Cl
3Cl2+8NH3═N2+6NH4Cl
.