摘要:4.吸附法 一般说来.选用适当的吸附剂.便可消除一些有害气体的外逸和释放.对于那些毒害不大的气体或剂量小的气体.仅用木炭粉或脱脂棉即可.对于难以燃烧的或可燃性的低浓度有机废液.可选用具有良好吸附性的物质.使废液被充分吸收后.与吸附剂一起焚烧.
网址:http://m.1010jiajiao.com/timu_id_428286[举报]
有BaCl2样品,其中含有少量Mg2+(约2%,以MgCl2计)。为了准确测定其纯度,采用盐酸滴定法:
①首先称取样品w g配成溶液。
②然后加入V1 mL浓度为c1 mol·L-1的NaOH溶液(过量)。
③充分沉淀后加入指示剂,再用浓度为c2 mol·L-1的标准盐酸滴定过量的碱,用去盐酸V2 mL。
试回答:
(1)若滴定前要除去Mg(OH)2沉淀,为保证测定的准确性,过滤时应当注意什么?__________________________________________________。
(2)若选用适当的酸碱指示剂也可不必过滤就滴定,选用的指示剂是____________________,不必过滤的原因是________________________________________。
(3)试样BaCl2纯度的计算公式为__________________________________________________。
查看习题详情和答案>>(2010?杭州二模)现有一定量含有NaOH杂质的Na2O2试样5.00g,分成等质量两份,用两种方法测定Na2O2试样的纯度.请填写下列空白:
(1)第一种方法:取第一份试样,从图1中选用适当的实验装置,设计一个实验以测定过氧化钠的纯度(可供选用的反应物只有CaCO3固体、MnO2固体、6mol?L-1盐酸和蒸馏水).
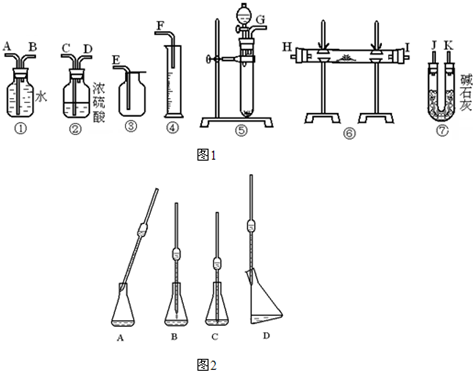
①若实验要求装置尽可能简单,应选用图1中的装置是(只要求写出图中装置的标号)
②所选用装置的连接顺序应是(填各接口的字母;连接胶管略).
③若实验过程中共产生氧气140mL(已折算成标准状况),则试样中过氧化钠的纯度为
(2)第二种方法:取第二份试样,配成250.00mL溶液,用0.255 0mol?L-1的标准盐酸滴定.
①取上述所配溶液25.00mL于锥形瓶中,操作如图2所示(手持部分省略):正确的操作是图
②滴定操作平行实验的数据记录如下表:
由表中数据计算样品中Na2O2纯度为
(3)若上述两个实验中不存在重大的操作失误,测得的实验数据也是真实可靠的,但以上两种方法测得的Na2O2纯度数据误差较大.
①你认为上述两种方法中,哪种方法更为可靠
②产生较大实验误差的原因最可能是
③在题中所给出的仪器和药品范围内,如何用简单的方法加以改进,使实验误差大为减少,写出改进的方法
查看习题详情和答案>>
(1)第一种方法:取第一份试样,从图1中选用适当的实验装置,设计一个实验以测定过氧化钠的纯度(可供选用的反应物只有CaCO3固体、MnO2固体、6mol?L-1盐酸和蒸馏水).

①若实验要求装置尽可能简单,应选用图1中的装置是(只要求写出图中装置的标号)
⑤①④
⑤①④
.②所选用装置的连接顺序应是(填各接口的字母;连接胶管略).
(G)接(A)(B)接(F)
(G)接(A)(B)接(F)
.③若实验过程中共产生氧气140mL(已折算成标准状况),则试样中过氧化钠的纯度为
39%
39%
.(2)第二种方法:取第二份试样,配成250.00mL溶液,用0.255 0mol?L-1的标准盐酸滴定.
①取上述所配溶液25.00mL于锥形瓶中,操作如图2所示(手持部分省略):正确的操作是图
D
D
,取溶液所用仪器的名称是移液管
移液管
.②滴定操作平行实验的数据记录如下表:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
78%
78%
.(3)若上述两个实验中不存在重大的操作失误,测得的实验数据也是真实可靠的,但以上两种方法测得的Na2O2纯度数据误差较大.
①你认为上述两种方法中,哪种方法更为可靠
第二种方法
第二种方法
?②产生较大实验误差的原因最可能是
过氧化钠和水反应一部分生成过氧化氢,使氧气不能全部逸出
过氧化钠和水反应一部分生成过氧化氢,使氧气不能全部逸出
.③在题中所给出的仪器和药品范围内,如何用简单的方法加以改进,使实验误差大为减少,写出改进的方法
反应前向过氧化钠中加入少量二氧化锰固体
反应前向过氧化钠中加入少量二氧化锰固体
. (2011?龙岩模拟)某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
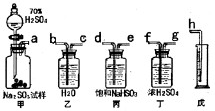
(2011?龙岩模拟)某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.方案一:根据试样与足量70%硫酸反应产生的SO2气体体积来测定.
(1)请从图中选用适当的装置,装置的连接顺序是(填接口字母)
aedh
aedh
.(2)按图连接好仪器,进行气密性检查的操作是
关闭分液漏斗活塞,将右侧导管放入水中,用手捂热锥形瓶,若导管口处有气泡冒出,松手后,导气管内上升一段稳定的水柱,则证明气密性完好
关闭分液漏斗活塞,将右侧导管放入水中,用手捂热锥形瓶,若导管口处有气泡冒出,松手后,导气管内上升一段稳定的水柱,则证明气密性完好
.(3)甲装置中发生反应的化学方程式为
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
.(4)称取2.0g试样,测得气体体积112mL(标况),则Na2SO3的质量分数为
31.5%
31.5%
.方案二:根据试样与钡盐溶液反应产生硫酸钡沉淀的质量来测定.流程如下:

(5)操作2名称是
洗涤
洗涤
,其操作方法是用玻璃棒引流,往漏斗中的沉淀上加入蒸馏水至浸没沉淀,待液体流净,重复操作2-3次
用玻璃棒引流,往漏斗中的沉淀上加入蒸馏水至浸没沉淀,待液体流净,重复操作2-3次
.若缺少该操作,测得的Na2SO3质量分数偏小
偏小
(填偏大、偏小或不变).(6)甲、乙两同学开展实验时,分别按下表叙述开展“操作1”(其余操作相同且符合实验规范要求),并得到表中所示的沉淀质量和亚硫酸钠质量分数(Na2SO3%)的计算表达式:
| 操作1 | 沉淀质量 | Na2SO3%计算表达式 | |||
| 甲 | 先往溶液中加入足量盐酸,再滴入足量BaCl2溶液 | b克 |
(1-
| ||
| 乙 | 先往溶液中加入足量Ba(NO3)2 溶液,再滴入足量盐酸 | c克 |
(1-
|
乙
乙
(填“甲”或“乙”)的“Na2SO3%计算表达式”有问题,因为先加足量的硝酸钡溶液,再滴入足量盐酸,产生的亚硫酸钡沉淀液会被硝酸氧化为硫酸钡沉淀
先加足量的硝酸钡溶液,再滴入足量盐酸,产生的亚硫酸钡沉淀液会被硝酸氧化为硫酸钡沉淀
.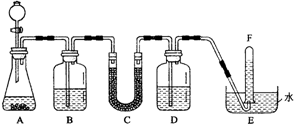 在潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可用于制取氧气.
在潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可用于制取氧气.(1)A是用CaCO3制取CO2的装置.写出A中发生反应的化学方程式:
CaCO3+2HCl═H2O+CO2↑+CaCl2
CaCO3+2HCl═H2O+CO2↑+CaCl2
.(2)按要求填写表中空格:
| 仪器编号 | 盛放的试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D | 吸收未反应的CO2气体 |
把E中的导管移出水面,关闭分液漏斗活塞用姆指堵住试管口,取出试管
把E中的导管移出水面,关闭分液漏斗活塞用姆指堵住试管口,取出试管
,证明收集到的气体是氧气的方法是用姆指堵住试管口,取出试管立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气本是氧气
用姆指堵住试管口,取出试管立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气本是氧气
.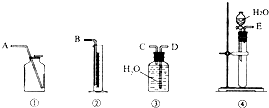 现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.所选用装置的连接顺序应是(填各接口的字母):
E、C、D、B
E、C、D、B
.| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |
计算CaC2的质量分数时,必需用的数据是
试样质量、锥形瓶和水的质量、第4、5次读数
试样质量、锥形瓶和水的质量、第4、5次读数
.不必作第6次读数的原因是第4、5次实验读数相同,表明锥形瓶内质量已达恒重,反应进行完全
第4、5次实验读数相同,表明锥形瓶内质量已达恒重,反应进行完全
.此试样中CaC2的质量分数为82%
82%
.(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下:
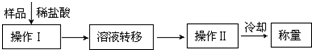
①操作Ⅱ的名称是
蒸发
蒸发
.②还需直接测定的物理量是
CaCl2质量
CaCl2质量
.③在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果
偏大
偏大
(填“偏大”、“偏小”或“不变”).④请指出该实验方案的2个不足之处
由于CaCl2具有很强的吸水性,称量的不一定是无水CaCl2的质量;CaO和CaC2的摩尔质量接近,实验误差会很大
由于CaCl2具有很强的吸水性,称量的不一定是无水CaCl2的质量;CaO和CaC2的摩尔质量接近,实验误差会很大
⑤请改进这个实验方案,至少解决其中1个不足之处
可以将Ca2+转化为CaCO3或CaC2O4沉淀,过滤后称其质量
可以将Ca2+转化为CaCO3或CaC2O4沉淀,过滤后称其质量
.