摘要:2.测蒸汽的温度这种类型的实验.多用于测量物质的沸点.由于液体在沸腾时.液体和蒸汽的温度相同.所以只要蒸汽的温度.①实验室蒸馏石油. ②测定乙醇的沸点.
网址:http://m.1010jiajiao.com/timu_id_428118[举报]
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
环形玻璃搅拌棒
环形玻璃搅拌棒
.(2)烧杯间填满碎纸条的作用是
减少实验过程中的热量损失
减少实验过程中的热量损失
.(3)要重复进行三次实验的目的是
多次测量求平均值可以减少实验误差
多次测量求平均值可以减少实验误差
.(4)大烧杯上如不盖硬纸板,求得的中和热数值
偏小
偏小
(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是室温较低时反应体系向环境散热比较快,热量损失大,结果偏低
室温较低时反应体系向环境散热比较快,热量损失大,结果偏低
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等、不相等”),所求中和热相等
相等
(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成nmolH2O所放出的热量,与酸碱的用量无关
因为中和热是指酸跟碱发生中和反应生成nmolH2O所放出的热量,与酸碱的用量无关
.(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会
偏小
偏小
;(填“偏大、偏小、无影响”).(7)三次平行操作所测得的数据如下:
| 温度 序号 |
起始温度t1/℃ | 终止温度 T2/℃ |
温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
46.3kJ?mol-1
46.3kJ?mol-1
.(2010?海南)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验.先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算Ar(Cu).为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→
(3)在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)=
-16
-16;
(4)在本实验中,使测定结果Ar(Cu)偏大的是
①Cu0未完全起反应 ②CuO不干燥 ③Cu0中混有不反应的杂质 ④碱石灰不干燥 ⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定
查看习题详情和答案>>

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为
2NH3+3CuO
3Cu+3H2O+N2
| ||
2NH3+3CuO
3Cu+3H2O+N2
;
| ||
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→
e→b→e
e→b→e
;(3)在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)=
| 18a |
| b |
| 18a |
| b |
(4)在本实验中,使测定结果Ar(Cu)偏大的是
①③
①③
(填序号);①Cu0未完全起反应 ②CuO不干燥 ③Cu0中混有不反应的杂质 ④碱石灰不干燥 ⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定
m(CuO)
m(CuO)
和m(Cu)
m(Cu)
,或m(Cu)
m(Cu)
和m(H2O)
m(H2O)
达到实验目的.影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.
(1)甲同学研究的实验报告如下表:
该同学的实验目的是研究
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图1装置进行定量实验.完成该实验应选用的实验药品是Mg(或Fe)和
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
查看习题详情和答案>>
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.

(1)甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快. |
反应物本身的性质
反应物本身的性质
对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度
温度
相同.(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图1装置进行定量实验.完成该实验应选用的实验药品是Mg(或Fe)和
0.5mol/L、2mol/L
0.5mol/L、2mol/L
(从给出的药品去选);应该测定的实验数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间
测定一定时间产生气体的体积或测定产生一定体积的气体所需时间
.实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是
催化剂
催化剂
的影响.(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
B
B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),
设计实验方案来研究影响反应速率的因素.
(1)甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. |
反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速度越快 |
反应物本身的性质
反应物本身的性质
对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度
温度
相同.(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验.完成该实验应选用的实验药品是
0.5mol/L、2mol/L
0.5mol/L、2mol/L
;应该测定的实验数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间
测定一定时间产生气体的体积或测定产生一定体积的气体所需时间
.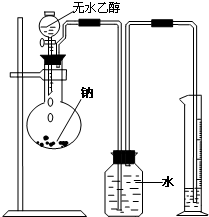 为测定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,设计如图所示的实验装置,通过测量量筒中水的体积,就可知道反应生成氢气的体积,从而确定乙醇分子的结构简式.
为测定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,设计如图所示的实验装置,通过测量量筒中水的体积,就可知道反应生成氢气的体积,从而确定乙醇分子的结构简式.