摘要:3.反应热.燃烧热.中和热.热化学方程式(1)反应熟:在化学反应中放出或吸收的热量.通常叫反应热用△H表示.单位:kJ?mol?1
网址:http://m.1010jiajiao.com/timu_id_427902[举报]
化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
(1)下列△H表示物质燃烧热的是
A.2H2(g)+O2(g)═2H2O(l)△H1
B.C(s)+1/2O2(g)═CO(g)△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)═CO2(g)△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H7
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的热化学方程式
(3)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与100mL浓度为5mol?L-1的KOH溶液完全反应生成一种正盐.则燃烧1mol丁烷放出的热量为
查看习题详情和答案>>
(1)下列△H表示物质燃烧热的是
△H4、△H5
△H4、△H5
;表示物质中和热的是△H6、△H8
△H6、△H8
(填“△H1”、“△H2”、“△H3”等).A.2H2(g)+O2(g)═2H2O(l)△H1
B.C(s)+1/2O2(g)═CO(g)△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)═CO2(g)△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H7
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的热化学方程式
C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=-1294.8kJ/mol
| 5 |
| 2 |
C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=-1294.8kJ/mol
.| 5 |
| 2 |
(3)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与100mL浓度为5mol?L-1的KOH溶液完全反应生成一种正盐.则燃烧1mol丁烷放出的热量为
16QkJ
16QkJ
.化学上常用燃烧法确定有机物的组成.如图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.

回答下列问题:
(1)A装置中分液漏斗盛放的物质是
(2)C装置(燃烧管)中CuO的作用是
(3)写出E装置中所盛放试剂的名称
(4)若将B装置去掉会对实验造成什么影响?
(5)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为
(6)要确定该有机物的化学式,还需要测定
查看习题详情和答案>>

回答下列问题:
(1)A装置中分液漏斗盛放的物质是
H2O2或(H2O)
H2O2或(H2O)
,写出有关反应的化学方程式2H2O2
2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑
| ||
2H2O2
2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑
.
| ||
(2)C装置(燃烧管)中CuO的作用是
使有机物充分氧化生成CO2和H2O
使有机物充分氧化生成CO2和H2O
.(3)写出E装置中所盛放试剂的名称
碱石灰或氢氧化钠
碱石灰或氢氧化钠
,它的作用是吸收CO2
吸收CO2
.(4)若将B装置去掉会对实验造成什么影响?
造成测得有机物中含氢量增大
造成测得有机物中含氢量增大
.(5)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为
CH2O
CH2O
.(6)要确定该有机物的化学式,还需要测定
测出有机物的相对分子质量
测出有机物的相对分子质量
. 化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.
化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.(1)许多化学反应的反应热可以直接测量,测量仪器叫做
量热计
量热计
.(2)下列△H表示物质燃烧热的是
△H4、△H5
△H4、△H5
(填序号);表示中和热的是△H6
△H6
(填“△H1、△H2、或△H3”等).A.2H2(g)+O2(g)═2H2O(l);△H1
B.C(s)+
| 1 |
| 2 |
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3
D.C(s)+O2(g)═CO2(g);△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H5
F.NaOH(ag)+HCl(ag)═NaCl(ag)+H2O(l);△H6
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7
(3)已知15g乙烷完全燃烧生成CO2和液态水,放热a kJ,下列热化学方程式正确是
C
C
.A.C2H6(g)+
| 7 |
| 2 |
B.C2H6(g)+
| 7 |
| 2 |
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4a kJ/mol
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2a kJ/mol
(4)充分燃烧一定丁烷放出热量161.9kJ,生成的CO2恰好与5mol/L 100mL KOH溶液完全反应生成正盐,则燃烧1mol丁烷放出能量为
2590.4kJ
2590.4kJ
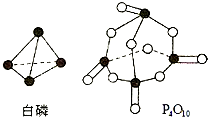
.(5)进一步研究表明,化学反应能量变化与键能有关.键能简单理解断开1mol化学键吸收能量.下表是键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能(kJ/mol) | 197 | 360 | 499 | X |
433.75
433.75
. 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.Ⅰ(1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式为:
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
.| 1 |
| 2 |
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极).分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是
负极
负极
(填“正极”或“负极”),气体M的分子式H2
H2
,a电极上发生的电极反应式为:H2+OH--2e-=2H2O
H2+OH--2e-=2H2O
.(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态.则在此电解过程中导线上转移的电子数为
4.14
4.14
mol.(保留小数点后2位)Ⅱ氢气是合成氨的重要原料.工业上合成氨的反应是:
N2(g)+3H2(g)?2NH3 (g)△H=-92.2kJ?mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是
③④
③④
.①N2、H2、NH3的体积分数不再改变;
②单位时间内生成2n mol NH3的同时生成3n mol H2;
③单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤混合气体的平均摩尔质量不再改变;
⑥混合气体的总物质的量不再改变.
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
27.7
27.7
kJ.②0~1小时内N2的平均反应速率
0.05
0.05
mol?L-1?h-1.③此条件下该反应的化学平衡常数K═
0.15
0.15
(保留两位小数).④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1mol,化学平衡向
正反应
正反应
方向移动(填“正反应”或“逆反应”或“不移动”.)化学反应一定伴随能量变化.
(1)将20gBa(OH)2?8H2O晶体与10g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌,闻到
(2)NaOH稀溶液跟稀盐酸反应的中和热与KOH稀溶液跟稀硫酸反应的中和热
(3)下列措施可以提高燃料的燃烧效率的是
查看习题详情和答案>>
(1)将20gBa(OH)2?8H2O晶体与10g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌,闻到
有刺激性气味
有刺激性气味
气味,用手触摸烧杯底部感觉烧杯底部很冷
烧杯底部很冷
,烧杯下面的玻璃片可能与烧杯烧杯下面的玻璃片被冻在一起
烧杯下面的玻璃片被冻在一起
. 说明Ba(OH)2?8H2O跟NH4Cl的反应是吸热
吸热
(填“吸热”或“放热”)反应.该反应的化学方程式Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
.(2)NaOH稀溶液跟稀盐酸反应的中和热与KOH稀溶液跟稀硫酸反应的中和热
相等
相等
(填“相等”或“不等”),原因是(用适当的文字和离子方程式解释)中和反应的实质是:H++OH-=H2O,两个反应参加反应的物质、生成物分别一样,反应物、生成物蕴含的化学能相同,所以反应放出的能量也相同
中和反应的实质是:H++OH-=H2O,两个反应参加反应的物质、生成物分别一样,反应物、生成物蕴含的化学能相同,所以反应放出的能量也相同
(3)下列措施可以提高燃料的燃烧效率的是
③④⑤⑥
③④⑤⑥
(填序号)①提高燃料的着火点,②降低燃料的着火点,③将固体燃料粉碎,④将液体燃料雾化,⑤将燃料煤气化处理,⑥通入适量空气.