网址:http://m.1010jiajiao.com/timu_id_427819[举报]
化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是________(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol/L KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算。
①下列滴定方式中,最合理的是(夹持部已分略去)______(填字母序号)。
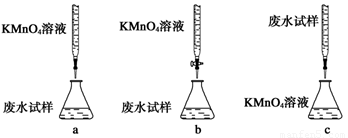
②滴定过程中,有关反应的离子方程式是__________________________________。
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加 1 mol/L的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是_________。
(4)用下图装置进行CO2性质的有关实验。
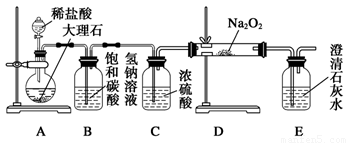
试剂瓶B中盛有饱和NaHCO3溶液,其目的是:
_______________________ __________。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系:
____________________ ___________。
查看习题详情和答案>>
(14分)化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是 (填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度。
甲组方案:
试剂X从下列试剂中选择:
a.0.1mol·L-1KMnO4(H2SO4酸化)溶液b.0.5mol·L-1NaOH溶液c.新制氯水d.KI溶液
①加入的试剂X为 (填字母序号),生成SO42-主要的离子方程式为 。
②甲组方案中,第iii步的“系列操作”包含的操作名称各为 。
乙组方案:
i.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ii.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1 mol·L-1KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
iii.记录数据,计算。
③乙组设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)

(3)某同学制备Fe(OH)3胶体:用洁净烧杯量取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是 。
(4)用下图装置进行CO2性质的有关实验。

①试剂瓶B中盛有饱和NaHCO3溶液,其目的是 。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
查看习题详情和答案>>
化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是________(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol/L KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算。
①下列滴定方式中,最合理的是(夹持部已分略去)______(填字母序号)。
②滴定过程中,有关反应的离子方程式是__________________________________。
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加 1 mol/L的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是_________。
(4)用下图装置进行CO2性质的有关实验。
试剂瓶B中盛有饱和NaHCO3溶液,其目的是:
_______________________ __________。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系:
____________________ ___________。
(1)目前常用的镍镉(Ni-Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是( )
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为__________________。
(3)下图是废弃镍镉电池中的重金属渗入水体后,进入人体的一条途径:
![]()
生物体D中重金属浓度________(“大于”“等于”“小于”)生物体A中重金属浓度,这是通过食物链________作用所引起的。除上述途径外,被污染水体中的重金属还可以直接通过________(途径)进入人体。
(4)另一种常用的电池锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电能)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为:
Li+MnO2![]() LiMnO2
LiMnO2
试回答:锂电池比容量特别大的原因是__________________。锂电池中的电解质溶液需用非水溶液配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因___________________。
查看习题详情和答案>>35.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
36.废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。
37.下图是废弃镍镉电池中的重金属渗入水体后,进入人体的一条途径:
![]()
生物体D中重金属浓度 (大于、等于、小于)生物体A中重金属浓度,这是通过食物链 作用所引起的。除上述途径外,被污染水体中的重金属还可以直接通过 (途径)进入人体。
38.另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成,电池总反应可表示为:Li+MnO2![]() LiMnO2
LiMnO2
试回答:锂电池比容量特别大的原因是 。锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因 。
39.下图是两个电池外壳上的说明文字
某型号进口电池 | 某型号国产电池 |
RECHARGEABLE 1.2V 500mAh STANDARD CHARGE 15h at 50mA | GNY 0.6(KR-AA) 1.2V 600mAh RECHARGEABLE STANDARDCHARGE 15h at 60mA |
上述进口电池的电动势是 伏。上述国产电池最多可放出 毫安时的电量:若该电池平均工作电流为0.03安,则最多可使用 小时。
查看习题详情和答案>>