题目内容
化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是________(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol/L KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算。
①下列滴定方式中,最合理的是(夹持部已分略去)______(填字母序号)。

②滴定过程中,有关反应的离子方程式是__________________________________。
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加 1 mol/L的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是_________。
(4)用下图装置进行CO2性质的有关实验。

试剂瓶B中盛有饱和NaHCO3溶液,其目的是:
_______________________ __________。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系:
____________________ ___________。
(1)c(2)①b ②2MnO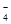 +5SO
+5SO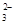 +6H+=2Mn2++5SO
+6H+=2Mn2++5SO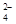 +3H2O
+3H2O
(3)搅拌导致胶体聚沉 液体呈透明的红褐色(或澄清红褐色)
(4)①除去HCl杂质气体 ②CaCO3(s)
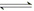 Ca2+(aq)+CO
Ca2+(aq)+CO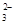 (aq)
(aq)
【解析】
试题分析:(1)a.高温下铁能和水蒸气反应,实验不能用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数,a不正确;
b.浓硫酸具有脱水性,不能用干燥的pH试纸测定浓硫酸的pH,b不正确;
c.量筒可以读数到0.1ml,所以用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液,c正确,答案选c。
(2)①酸性高锰酸钾溶液应该放在酸式滴定管中,a中酸性高锰酸钾溶液放在碱式滴定管中,因此a不正确,b正确;应该用高锰酸钾溶液滴定废水,选项c不正确,答案选b。
②高锰酸钾具有强氧化性,能把SO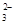 氧化,所以滴定过程中,有关反应的离子方程式是2MnO
氧化,所以滴定过程中,有关反应的离子方程式是2MnO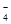 +5SO
+5SO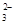 +6H+=2Mn2++5SO
+6H+=2Mn2++5SO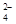 +3H2O。
+3H2O。
(3)将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体,加热直到液体变为透明的红褐色停止加热,无需玻璃棒搅拌。所以该实验失败的原因是搅拌导致胶体聚沉。
(4)①盐酸易挥发,生成的CO2中含有氯化氢气体,所以饱和碳酸氢钠溶液的作用是除去HCl杂质气体。
②碳酸钙是难溶性物质,存在溶解平衡,方程式是CaCO3(s) 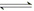 Ca2+(aq)+CO
Ca2+(aq)+CO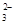 (aq)。
(aq)。
考点:考查化学实验基本操作、氧化还原反应方程式的书写、氢氧化铁胶体的制备、气体的净化和溶解平衡等
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容在高考命题中一方面是单独命题,另一方面是出现在综合实验试题中,就前者来说,今后仍然是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。



