摘要:9.物理性质与化学性质 物理性质化学性质概念物质不需要发生化学变化就能表现出来的性质物质在发生化学变化时表现出来的性质实质物质的分子组成和结构没有发生改变时呈现的性质物质的分子组成和结构发生改变时呈现的性质性质包括内容颜色.状态.气味.味道.密度.熔点.沸点.溶解性.导电性.导热性等一般指跟氢气.氧气.金属.非金属.氧化物.酸.碱.盐能否发生反应及热稳定性等
网址:http://m.1010jiajiao.com/timu_id_427812[举报]
就物理性质而言,第二周期原子序数最小的元素的单质是 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式: 。
查看习题详情和答案>>
就物理性质而言,第二周期原子序数最小的元素的单质是 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式: 。
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)=4C (g)△H>0 达到平衡时,c(A)=2mol?L-1,c(B)=7mol?L-1,c(C)=4mol?L-1.试确定B的起始浓度c(B)的取值范围是
3mol/L≤c(B)≤9mol/L
3mol/L≤c(B)≤9mol/L
;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是C
C
.A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
( 填“A”或“B”). 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2. 则 m1<
<
m2 ( 选填“<”、“=”、“>”)(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
减小
减小
(填“增大”、“减小”或“不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=| 2nB |
| 3tB |
| 2nB |
| 3tB |
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:
Cu(OH)2(s)=Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)[c(OH-)]2=2×10-20
当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c( Cu2+)=0.02mol?L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于
5
5
; 要使0.2mol?L-1的CuSO4 溶液中Cu2+沉淀较为完全 (使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为6
6
.(5)常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色.则该溶液呈
碱性
碱性
性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确
向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确
.[化学选修-物质结构与性质]
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
(2)A最简单的氢化物的分子空间构型是
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是
(4)晶体熔点:DC
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
查看习题详情和答案>>
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)A最简单的氢化物的分子空间构型是
正四面体
正四面体
,其中心原子采取sp3
sp3
杂化,属于非极性分子
非极性分子
(填“极性分子”和“非极性分子”).(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 | M | F | |
| 电离能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
Mn2+的3d轨道电子排布为半满状态较稳定
Mn2+的3d轨道电子排布为半满状态较稳定
;(4)晶体熔点:DC
>
>
EC(填“<、=、>”),原因是MgO与CaO都为离子晶体,Mg2+半径小于Ca2+,则MgO的晶格能大于CaO,所以熔点高
MgO与CaO都为离子晶体,Mg2+半径小于Ca2+,则MgO的晶格能大于CaO,所以熔点高
.(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
H2O2分子间存在氢键,与水分子可形成氢键
H2O2分子间存在氢键,与水分子可形成氢键
?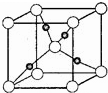 [化学--选修物质结构]
[化学--选修物质结构]发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目近日已获批复.已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化.
(1)根据等电子原理,写出CO分子的结构式
C≡O
C≡O
.(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式
[Ar]3d104s1
[Ar]3d104s1
.(3)右图是铜的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为
Cu2O
Cu2O
.(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是
NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键
NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键
.(5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛,甲醇的沸点比甲醛的高,其主要原因是
甲醇分子之间形成氢键
甲醇分子之间形成氢键
;甲醛分子中碳原子轨道的杂化类型为sp2杂化
sp2杂化
; 1mol甲醛分子中σ键的数目为3NA
3NA
.