摘要: 不定范围推断:常见元素化合物的推断.该题目的主要特点是:依据元素化合物之间相互转化时所产生的一系列实验现象.进行推理判断.确定有关的物质.题目往往综合性较强.具有一定的难度.从试题形式来看.有叙述型.图表型等.解题关键:见题后先迅速浏览一遍.由模糊的一遍“扫描 .自然地在头脑中产生一个关于该题所涉及知识范围等方面的整体印象.然后从题中找出特殊现象或特殊性质的描述.作为解题的突破口.进而全面分析比较.作出正确判断.
网址:http://m.1010jiajiao.com/timu_id_412142[举报]
(2008?驻马店二模)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:
(1)X的元素符号为
(2)由以上元素中的两种元素组成的物质中有一种能与H2O反应释放出空气中的主要成分之一的气体,则该物质的电子式为
 ,化学键类型为
,化学键类型为
(3)由X、Y、Z所形成的常见离子化合物的化学式为
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是
查看习题详情和答案>>
(1)X的元素符号为
H
H
,元素Z在周期表中的位置为第二周期ⅥA族
第二周期ⅥA族
.(2)由以上元素中的两种元素组成的物质中有一种能与H2O反应释放出空气中的主要成分之一的气体,则该物质的电子式为


离子键、共价键
离子键、共价键
.(3)由X、Y、Z所形成的常见离子化合物的化学式为
NH4NO3
NH4NO3
,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
| ||
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是
原子晶体
原子晶体
.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用具体的元素符号回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: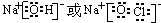
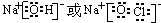 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.Na2SO3 c.KMnO4.
查看习题详情和答案>>

(1)④、⑤、⑥的原子半径由大到小的顺序为
Na>Al>O
Na>Al>O
.(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
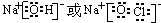
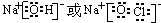
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a
a
.a.MnO2 b.Na2SO3 c.KMnO4.
短周期常见元素形成的纯净物A、B、C、D、E转化关系如图1所示,物质A与物质B之司的反应不在溶液中进行(E可能与A、B两种物质中某种相同)

请同答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式
(2)若C与水发生复分解反应,E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物,写出实验室制取D的离子方程式为
(3)若C是有色气体,D是一种强酸,则:
①C与水反应的化学方程式为
②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,浓H2SO4变为红棕色,且Ⅱ装置末发现有气体逸出,则你得出的结论是
查看习题详情和答案>>

请同答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式
Na2O2(或NaH)
Na2O2(或NaH)
.(2)若C与水发生复分解反应,E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物,写出实验室制取D的离子方程式为
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
.(3)若C是有色气体,D是一种强酸,则:
①C与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,浓H2SO4变为红棕色,且Ⅱ装置末发现有气体逸出,则你得出的结论是
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
.短周期常见元素形成的纯净物A、B、C、D、E转化关系如图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同).

请回答下列问题:
Ⅰ.若A为金属,C是离子化合物,D是一种常见的强碱.
(1)写出A的离子结构示意图
 .C的化学式
.C的化学式
(2)D与等物质的量醋酸反应所得溶液的PH
Ⅱ.若C是一种气体,D是一种强酸,则:
(3)C与水反应的化学方程式为
(5)有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图装置进行实验.实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是
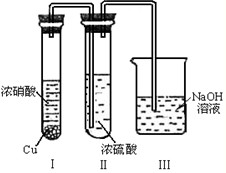
查看习题详情和答案>>

请回答下列问题:
Ⅰ.若A为金属,C是离子化合物,D是一种常见的强碱.
(1)写出A的离子结构示意图


Na2O2
Na2O2
.(2)D与等物质的量醋酸反应所得溶液的PH
>
>
7,(填“>”,“<”,“=”).原因是(用文字和离子方程式说明)生成的醋酸钠是强碱弱酸盐,水解呈碱性.离子方程式为CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
 CH3COOH+OH-
CH3COOH+OH-生成的醋酸钠是强碱弱酸盐,水解呈碱性.离子方程式为CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
. CH3COOH+OH-
CH3COOH+OH-Ⅱ.若C是一种气体,D是一种强酸,则:
(3)C与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.(5)有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图装置进行实验.实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
.