摘要:MgCl2MgCl2+2H2O Mg(OH)2+2HClMg2++2H2O Mg(OH)2+2H+
网址:http://m.1010jiajiao.com/timu_id_411939[举报]
(2010?南昌二模)I.已知P4O6分子结构中每个原子均达到8个电子的稳定结构.1molP4O6中,共价键总数为
II.A、B、C、D均为短周期元素组成的中学教材中常见的物质,且都含有同一种元素,它们具有如下关系:
A+H2O
D↓+x↑
B+H2O
D↓+y↑
C+H2O→D↓+z↑(均未配平)
溶解性:z>y>x.
请回答下列问题:
(1)A、B、C、D中均含有的同种元素在周期表中的位置是:
(2)写出D的电子式: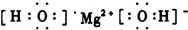
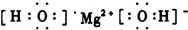 ;y的结构式
;y的结构式
(3)写出A+H2O
D↓+x↑的方程式:
查看习题详情和答案>>
7.224×1024
7.224×1024
.II.A、B、C、D均为短周期元素组成的中学教材中常见的物质,且都含有同一种元素,它们具有如下关系:
A+H2O
| △ |
B+H2O
| △ |
C+H2O→D↓+z↑(均未配平)
溶解性:z>y>x.
请回答下列问题:
(1)A、B、C、D中均含有的同种元素在周期表中的位置是:
第三周期
第三周期
周期ⅡA
ⅡA
族;(2)写出D的电子式:
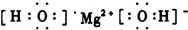
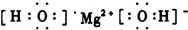
O=C=0
O=C=0
;z的空间构型:三角锥形
三角锥形
.(3)写出A+H2O
| △ |
Mg+2H2O
Mg(OH)2↓+H2↑
| ||
Mg+2H2O
Mg(OH)2↓+H2↑
;其反应类型:
| ||
置换反应
置换反应
.(2011?松江区模拟)C和Si元素在化学中占有极其重要的地位.
(1)写出Si原子核外最外层电子排布式
(2)SiC的晶体结构与晶体硅的相似,微粒间存在的作用力是
(3)氧化物MO的电子总数与SiC的相等,则MCl2水溶液显
(4)C、Si为同一主族的元素,证明两者非金属性强弱的事实有
查看习题详情和答案>>
(1)写出Si原子核外最外层电子排布式
3s23p2
3s23p2
. C、Si和O元素的原子半径由小到大的顺序为O<C<Si
O<C<Si
.(2)SiC的晶体结构与晶体硅的相似,微粒间存在的作用力是
共价键
共价键
.SiC晶体熔点>
>
晶体硅(填<、>、=).(3)氧化物MO的电子总数与SiC的相等,则MCl2水溶液显
酸性
酸性
性,相关的离子方程式Mg2++2H2O?Mg(OH)2+2H+
Mg2++2H2O?Mg(OH)2+2H+
.(4)C、Si为同一主族的元素,证明两者非金属性强弱的事实有
将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
.(举一例说明) (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:(1)用化学符号表示下列4种微粒:
A
H2O
H2O
;BNH3
NH3
;CNH4+
NH4+
;DOH-
OH-
.(2)写出A、B、E三种微粒反应的离子方程式:
Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+
Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+
.(Ⅱ)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
请回答下列问题:
(1)D的化学式是
NH3
NH3
,E的化学式是NH4Cl
NH4Cl
.(2)A和B反应生成C的化学方程式是:
H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
(3)E和F反应生成D、H和G的化学方程式是:
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
| ||
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
.
| ||
 I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是ABC
ABC
A.温度越高,镁与水反应的速率越快
B.镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑
C.氢氧化镁显碱性,且在水中有一定的溶解性
D.氢氧化镁是离子化合物,它的电子式可表示为:

II 一定温度下,在容积为 VL的密闭容器中进行反应:aN(g)
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示:(1)此反应的化学方程式中a/b=
2
2
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
| 1 |
| (t2-t1)×v |
| 1 |
| (t2-t1)×v |
(3)下列叙述能说明上述反应达到平衡状态的是
C、E
C、E
(填序号)A.反应中M与N的物质的量之比为1:1
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.正反应速率与逆反应速率均为零.
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并作了下面的实验记录(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系).
请你根据上面的记录填写下面实验报告中未完成的内容.
(1)实验目的:研究
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等.
仪器:①
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
①
(4)实验结论:
查看习题详情和答案>>
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
(1)实验目的:研究
同周期
同周期
元素性质递变规律.(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等.
仪器:①
酒精灯
酒精灯
,②滤纸
滤纸
,③烧杯
烧杯
,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等.(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | B B |
F F |
A A |
C C |
D D |
E E |
Mg+2H2O=Mg(OH)2+H2↑
Mg+2H2O=Mg(OH)2+H2↑
,②Na2S+Cl2=2NaCl+S↓
Na2S+Cl2=2NaCl+S↓
,(4)实验结论:
同一周期,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强.
同一周期,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强.
.