网址:http://m.1010jiajiao.com/timu_id_409507[举报]

B. 一定温度下,利用pH计测定不同浓度醋酸溶液的pH 值,得到数据(如上表)
当醋酸浓度为0.1mol/L时,通过计算求得该温度下醋酸的电离度为1%
C. 已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为 5.6×10-5 mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为 5×10-5mol/L
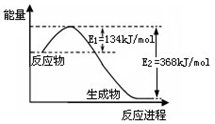
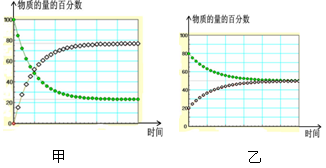
D. 在不同条件下进行的异构化反应 X
 Y 的进程图解。图中的“
Y 的进程图解。图中的“ ”是X,“
”是X,“ ”是Y 则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小
”是Y 则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 ①混合后溶液的pH=8的原因(用离子方程式表示):
②水电离出的c(H+):混合溶液
③已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各种离子的浓度以它们化学计量数为次方的乘积叫溶度积常数(Ksp). 例如:Cu(OH)2?Cu2++2OH-,Ksp=c(Cu2+)?c(OH-)2=2×10-20.当溶液中各种离子的浓度次方的乘积大于溶度积时,则产生沉淀,反之固体溶解.
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2 沉淀,应调整溶液的pH>5,原因是(用数据说明)
②要使0.2mol/LCuSO4溶液中Cu2+ 沉淀较为完全(即使Cu2+ 浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH≥多少?写出计算过程:
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
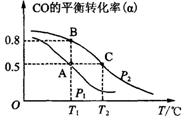
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
查看习题详情和答案>>(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)①若已知2SO2(g)+O2(g)
 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-12NO(g)+O2(g)
 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1则SO2(g)+NO2(g)
 SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g)
 SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)
 CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。