题目内容
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:

①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)①若已知2SO2(g)+O2(g)
 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-12NO(g)+O2(g)
 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1则SO2(g)+NO2(g)
 SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g)
 SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)
 CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
(1)(2分) SO2、NO2 (2)(8分)①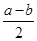 ②ad ③0.075mol/(L?min) 9
②ad ③0.075mol/(L?min) 9
(3)(6分)①放热(1分) ②Ka=Kb>KC(1分) ③O2 + 2H2O + 4e-=4OH-(2分) 30(2分)
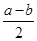 ②ad ③0.075mol/(L?min) 9
②ad ③0.075mol/(L?min) 9(3)(6分)①放热(1分) ②Ka=Kb>KC(1分) ③O2 + 2H2O + 4e-=4OH-(2分) 30(2分)
试题分析:(1)SO2和NO2排入大气中最终分别变为硫酸和硝酸,从而形成酸雨。CO不能形成酸雨。
(2)①若已知2SO2(g)+O2(g)
 2SO3(g) ΔH=a kJ·mol-1、2NO(g)+O2(g)
2SO3(g) ΔH=a kJ·mol-1、2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1,则根据盖斯定律可知前者减去后者即得到反应2SO2(g)+2NO2(g)
2NO2(g) ΔH=b kJ·mol-1,则根据盖斯定律可知前者减去后者即得到反应2SO2(g)+2NO2(g)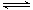 2SO3(g)+
2SO3(g)+2NO(g),因此反应SO2(g)+NO2(g)
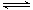 SO3(g)+NO(g) ΔH=
SO3(g)+NO(g) ΔH=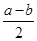 kJ·mol-1。
kJ·mol-1。②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、根据反应式可知,反应前后气体的体积不变,因此压强始终是不变,则体系压强保持不变不能说明反应达到平衡状态;b、颜色的深浅与NO2的浓度有关系,所以当混合气体的颜色保持不变时,则说明NO2的浓度不再发生变化,因此反应达到平衡状态;c、NO的物质的量保持不变说明正逆反应速率相等,达到平衡状态;d、每生成1 mol SO3的同时,一定消耗1 molNO2,因此该关系是始终成立的,不能说明反应达到平衡状态,答案选ad。
③ SO2(g)+NO2(g)
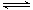 SO3(g)+NO(g)
SO3(g)+NO(g)起始量(mol) 1 1 0 0
转化量(mol) x x x x
平衡量(mol) 1-x 1-x x x
由于平衡时容器中NO与NO2的体积比为3︰1
则3-3x=x
解得x=0.75mol
所以平衡时消耗SO2的浓度是0.75mol÷2L=0.375mol/L
则这段时间内SO2的反应速率υ(SO2)=0.375mol/L÷5min=0.075mol/(L?min)
由于反应前后体积不变,所以可以用物质的量代替浓度计算平衡常数
则此反应在该温度下的平衡常数K=
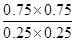 =9
=9(3)①根据图像可知,在压强不变的条件下,随着温度的升高,CO的转化率降低。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应。
②平衡常数只与温度有关系,A和B两点温度相同,则平衡常数相等。升高温度平衡向逆反应方向移动,平衡常数减小,所以三点平衡常数的大小关系是Ka=Kb>KC。
③原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。所以在燃料电池中燃料在负极通入,氧气或空气在正极通入。由于电解质是氢氧化钾溶液,显碱性,所以正极电极反应式为O2 + 2H2O + 4e-=4OH-;根据图像可知A点CO的转化率是0.5,则平衡常数生成甲醇的物质的量是10mol×0.5=5mol。甲醇中碳元素的化合价是-2价,反应后被氧化为+4价,失去6个电子,所以5mol甲醇反应转移电子的物质的量是5mol×6=30mol。

练习册系列答案
相关题目

 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①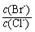 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0)
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。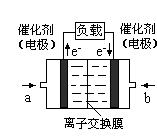
 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1

 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0

 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol