摘要:H2C2O4?xH2O ~ H2C2O4 ~ xH2O 1mol 18xg
网址:http://m.1010jiajiao.com/timu_id_404780[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
D
B
C
C
B
D
A
C
D
D
C
C
A
AD
B
17、3.2 ,D
18、(1)不会,当酚酞变色时的PH值条件下,HCl是与NaOh发生反应,不会与BaCO3作用。
(2)浅红色 无色
(3)不能。因滴定管下方刻度线距活塞处有一定空间,不能测出其所用的滴定液体积
(4)不能 偏高
19、(1)BDCEAF
(2)防止将标准液稀释
(3)偏大
(4)滴定管活塞;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(5)偏小 (6)偏大
20、NaOH+HCl====NaCl+H2O
Na2CO3+HCl====NaHCO3+NaCl
NaOH+HCl====NaCl+H2O
Na2CO3+2HCl====2NaCl+CO2↑+H2O;

 某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.
某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
| 滴定次数 | 待测草酸溶液体积(mL) | 0.1000mol/LKMnO4标准溶液体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 10.02 |
| 第二次 | 25.00 | 0.22 | 11.32 |
| 第三次 | 25.00 | 1.56 | 11.54 |
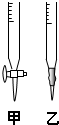
(1)滴定时,将KMnO4标准液装在右图中的
甲
甲
(填“甲”或“乙”)滴定管中.(2)本实验滴定达到终点的标志可以是
当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
.(3)通过上述数据,计算出x=
2
2
.(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会
偏大
偏大
(填“偏大”、“偏小”或“不变”,下同).②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会
偏小
偏小
.草酸晶体的组成可表示为H2C2O4?xH2O,为测定x值,做了如下实验:
①称取W g纯草酸晶体,将其配制成100.0mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为a mol?L-1的KMnO4标准溶液进行滴定,滴定时发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
请回答:
(1)滴定时,将KMnO4标准液装在 滴定管中,操作时用 手拿锥形瓶.
(2)若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 (填“偏大”“偏小”或“不变”).
(3)假设滴定终点时,用去V mL KMnO4溶液,则待测草酸溶液的物质的量浓度为 mol?L-1.
查看习题详情和答案>>
①称取W g纯草酸晶体,将其配制成100.0mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为a mol?L-1的KMnO4标准溶液进行滴定,滴定时发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
请回答:
(1)滴定时,将KMnO4标准液装在
(2)若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会
(3)假设滴定终点时,用去V mL KMnO4溶液,则待测草酸溶液的物质的量浓度为
草酸晶体的组成可表示为H2C2O4?xH2O,为测定x值,进行下列实验.
①称取m g草酸晶体,配成100.0mL溶液.
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol?L-1 KMnO4溶液滴定.滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和
(2)在实验②中,滴定时KMnO4溶液应装在
(3)在滴定过程中,目光应注视
(4)若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出草酸晶体x值为
-5
-5.
(5)若读取读数a时仰视,读取读数b时俯视,则所测x值
查看习题详情和答案>>
①称取m g草酸晶体,配成100.0mL溶液.
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol?L-1 KMnO4溶液滴定.滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和
100mL容量瓶
100mL容量瓶
、胶头滴管
胶头滴管
、玻璃棒
玻璃棒
.(2)在实验②中,滴定时KMnO4溶液应装在
酸
酸
式滴定管中,锥形瓶中不需要
不需要
(填“需要”或“不需要”)滴加指示剂.(3)在滴定过程中,目光应注视
锥形瓶中溶液颜色的变化
锥形瓶中溶液颜色的变化
.(4)若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出草酸晶体x值为
| 50m |
| 9c?(b-a) |
| 50m |
| 9c?(b-a) |
(5)若读取读数a时仰视,读取读数b时俯视,则所测x值
偏大
偏大
(填“偏大”、“偏 小”或“不变”). 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4?xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4?xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO- 2 |
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4.
③用浓度为0.100 0mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL.
(1)滴定时,KMnO4标准液装在如图中的
甲
甲
(填“甲”或“乙”)滴定管中.(2)本实验滴定达到终点的标志可以是
当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
.(3)通过上述数据,求得x=
2
2
.若滴定终点时俯视滴定管刻度,则由此测得的x值会偏大
偏大
(填“偏大”、“偏小”或“不变”,下同).已知:草酸晶体(H2C2O4?xH2O)于100℃开始失水,101.5℃熔化,约157℃时升华,于175℃受热分解.某校甲、乙两组学生用不同方式探究草酸的部分化学性质并测定其结晶水的含量.
Ⅰ.甲组用滴定法测定草酸晶体中结晶水的含量.
步骤一:称取5.0g纯净的草酸晶体,配制成250mL溶液.
步骤二:取0.04mol?L-1标准酸性KMnO4溶液25.00mL于锥形瓶中,用所配溶液滴定至终点.
请回答下列问题:
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入 ,洗涤,定容,摇匀.
②完善下面滴定反应的离子方程式:
MnO4-+ H2C2O4+ H+= Mn2++ + H2O
③在“步骤一”和“步骤二”测定操作中需要重复进行的操作是 (填“步骤一”或“步骤二”).
④其它操作均正确的情况下,下列操作可能使测定结果偏大的是
A.锥形瓶瓶壁残留蒸馏水就转移入酸性KMnO4溶液进行滴定
B.酸式滴定管用蒸馏水洗后未用待测溶液润洗就加入待测液进行滴定
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失
D.滴定完成后俯视刻度
Ⅱ.乙组同学为探究草酸的性质,按下图所示装置进行实验(夹持装置未标出):
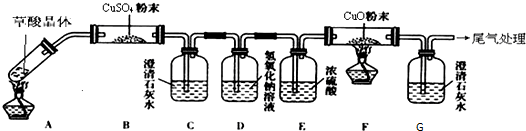
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末部分变红.据此回答:
①草酸分解的化学方程式为 .
②乙组同学将B装置称量,却发现B装置质量增量比理论值大,该小组同学认真分析断定操作无误,则其原因可能是 .
③乙组中某同学认为可以利用加热分解的草酸晶体的质量和F装置中固体质量的减少就可以计算出晶体中结晶水的含量,立即遭到其他同学的反对,其反对的理由是 .
查看习题详情和答案>>
Ⅰ.甲组用滴定法测定草酸晶体中结晶水的含量.
步骤一:称取5.0g纯净的草酸晶体,配制成250mL溶液.
步骤二:取0.04mol?L-1标准酸性KMnO4溶液25.00mL于锥形瓶中,用所配溶液滴定至终点.
请回答下列问题:
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入
②完善下面滴定反应的离子方程式:
③在“步骤一”和“步骤二”测定操作中需要重复进行的操作是
④其它操作均正确的情况下,下列操作可能使测定结果偏大的是
A.锥形瓶瓶壁残留蒸馏水就转移入酸性KMnO4溶液进行滴定
B.酸式滴定管用蒸馏水洗后未用待测溶液润洗就加入待测液进行滴定
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失
D.滴定完成后俯视刻度
Ⅱ.乙组同学为探究草酸的性质,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末部分变红.据此回答:
①草酸分解的化学方程式为
②乙组同学将B装置称量,却发现B装置质量增量比理论值大,该小组同学认真分析断定操作无误,则其原因可能是
③乙组中某同学认为可以利用加热分解的草酸晶体的质量和F装置中固体质量的减少就可以计算出晶体中结晶水的含量,立即遭到其他同学的反对,其反对的理由是