网址:http://m.1010jiajiao.com/timu_id_404467[举报]
一、1.B 2.A?
3.解析:v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6。
答案:D?
4.BC 5.B 6.B 7.D 8.BD?
9.解析:由①②组数据解得m=1,由②③组数据解得n= 。
。
答案:D
二、10.(1)0.013 (2)1.0 催化剂 (3)> >
(4)吸热 温度升高时,平衡向右移动?
11.①
12.④>③=②>①?
13.
 (
( -x)?mol?L-1?min-1
-x)?mol?L-1?min-1
14.(1)1∶50 根据勒夏特列原理,通入过量而廉价的氧气,可提高SO2的转化率
(2)废气中每小时排出的SO2的体积为:1
(3)SO2 ~ 2NH3 ~ (NH4)2SO4?
 mol?
mol?
 mol
mol
 mol
mol
故可得(NH4)2SO4: mol×1
mol×1
消耗氨气: mol×2×1
mol×2×1
![]()
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
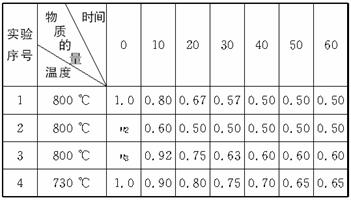
根据上表数据,完成下列填空:
①在实验1中反应在10—20 min内反应的平均速率为 ① mol·(L·min)-1;实验2中采取的措施是 ② ;实验3中n3 ③ 1.0 mol(填“>”“=”或“<”)。
②比较实验4和实验1,可推测该反应中Q ④ 0(填“>”“=”或“<”),理由是 ⑤ 。
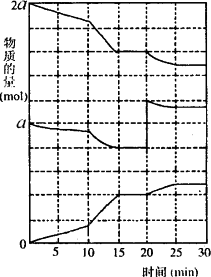
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如下图所示,根据图中所示判断下列说法正确的是 ⑥ 。
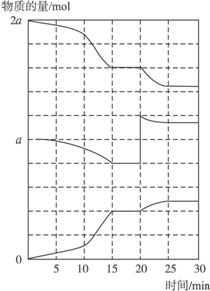
a.10—15 min可能是升高了温度 b.10—15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积 d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5 mol A(g)和3 mol B(g),此时容器的压强为p(始)。反应进行并达到平衡后,测得容器内气体压强为p(始)的![]() 。若相同条件下,向上述容器中分别通入a mol A(g)、b mol B(g)、c mol C(g),欲使达到新平衡时容器内气体压强仍为p(始)的
。若相同条件下,向上述容器中分别通入a mol A(g)、b mol B(g)、c mol C(g),欲使达到新平衡时容器内气体压强仍为p(始)的![]() 。
。
①a、b、c必须满足的关系是 ⑦ , ⑧ 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 ⑨ 。
查看习题详情和答案>>
| |||||||||||||||
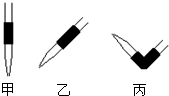 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:步骤一:配制250mL 0.10mol/L NaOH标准溶液.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作4次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.00 | 20.00 |
| 4 | 0.10 | 19.98 | 20.00 |
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是
(3)根据上述数据,可计算出该盐酸的浓度为
(4)排去滴定管中气泡的方法应采用如图的
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
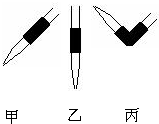 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:(1)配制100mL 0.1000mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.1000 | 22.62 | 20.00 |
| 2 | 0.1000 | 22.72 | 20.00 |
| 3 | 0.1000 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
③排去碱式滴定管中气泡方法应采用操作
④在上述实验中,下列操作(其他操作正确)分别对测定结果造成什么影响?(填“偏低”、“偏高”、“无影响”)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.10mol/L NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)
②称量0.4克氢氧化钠固体所需仪器有:天平(带砝码、镊子)、
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
③排去碱式滴定管中气泡的方法应采用(如图)操作
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.