网址:http://m.1010jiajiao.com/timu_id_404200[举报]
一、1.C 2.C 3.D?
4.解析:n(NaOH)=0.5 mol?L-1×
若全部为NaOH,m=
答案:C?
5.B 6.B 7.C?
8.解析:n(H2SO4+SO3)= n(NaOH)=0.125 mol?L-1×
n(NaOH)=0.125 mol?L-1× =0.00125 mol。设其中含SO3x mol,则有:
=0.00125 mol。设其中含SO3x mol,则有:
x= mol m(SO3)=
mol m(SO3)= mol×
mol× ×100%=15%。
×100%=15%。
答案:A?
9.C 10.C?
二、11.(1)C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O?
2SO2↑+CO2↑+2H2O?
(2)④→②→①→③?
(3)验证产物气流中有SO2 将SO2全部氧化吸收 确证产物中SO2已被B瓶溶液全部氧化吸收
(4)无水硫酸铜 水蒸气 由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前
(5)澄清石灰水 CO2?
12.(1)SO2?(2)BCF BDF?
13.(1)CuSO4 H2SO4 SO3?

2 mol∶
14.(1)A/B=147/125
(2)A=B>
15.(1)308 (2)52?
(3)设SO2为x(体积分数),则有?
4×( ×11+0.0800)=1-0.0800-x?x=0.0923?
×11+0.0800)=1-0.0800-x?x=0.0923?
(4)①13b=200-
②

环境保护
一、选择题
1.目前排放到空气中的二氧化碳逐年增加,对此科学家最担心的是
A.会使空气中的氧含量下降,不足以供给人类呼吸
B.会使地球温度升高,冰川融化,生态失衡
C.会使人体吸进大量二氧化碳,损害健康
D.会使石灰岩大量溶解,破坏自然风光
2.科技文献经常出现的下列词汇,其中与相关物质的颜色并无联系的是
A.赤色海潮 B.白色污染 C.绿色食品 D.棕色烟气
3.燃放爆竹对环境的危害是
A.有毒有害气体、粉尘污染 B.纸屑污染 C.噪声 D.前列三项总和
4.某年“世界无烟日”的主题是“清洁空气,拒吸二手烟”。“二手烟”燃烧产生的烟气中含有三种主要毒素,除烟碱和致癌物焦油外,还有一种不易注意的有毒物质是
A.NO B.SO
5.人体内含有多种元素,其中许多元素都是人体所需的,但有些元素尚未证实其生理功能,相反,在食品中它们含量稍高会引起毒性反应,食品卫生法对它们的最高标准有极严格的规定。这些元素是①Na ②Mg ③As ④Cd ⑤Ca ⑥Zn ⑦Hg ⑧Pb ⑨Cu ⑩K中的
A.⑥⑦⑧⑨ B.②④⑥⑧ C.③④⑦⑧ D.②④⑥⑦⑧
6.据各地报纸报道,在一些建筑工地的食堂里常发生将工业用盐当作食盐用,引起工人食物中毒的现象,该工业用盐对人有致癌使用。这种盐中含有致癌作用物质的化学式是
A.MgCl2 B.KCl C.NaNO2 D.MgSO4
7.你认为减少酸雨产生的途径可采取的措施是①少用煤燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
8.发展“绿色食品”是提高人类生存质量 维护健康水平的重要措施,绿色食品系指
A.绿颜色的营养食品 B.有叶绿素的营养食品
C.经济附加值高的营养食品 D.安全、无公害的营养食品
9.1998年长江洪水泛滥,在受灾区为了保证饮水质量,医务人员在做好防病减灾的同时,还向灾民们发放了饮水清洁剂。你认为下列物质中适宜做饮水清洁剂的是
A.NaClO、KAl(SO4)2?12H2O B.NaOH、Cl2
C.KMnO4、A12(SO4)3 D.NaHCO3、KAl(SO4)2
10.控制城市空气污染的方法可以有
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
11.造成大气污染的SO2主要来源于
A.自然界含硫化合物的分解和氧化 B.火山喷发
C.工厂排出的尾气 D.大量燃烧含硫燃料
12. 环境污染已成为人类的特大杀手,各种污染数不胜数。下列名词与污染无关的是
A.温室效应 B.红潮 C.酸雨 D.大脖子病 (E)光化学烟雾 (F)潮汐
13. 90年代初,国际上提出了“预防污染”这一新概念,绿色化学是预防污染的基本手段。下列各项中属于绿色化学的是
A.杜绝污染源 B.减少有毒物 C.治理污染点 D.处理废弃物
14.下列物质中,不能用于净化饮用水,或用于饮用水消毒的物质是
A.明矾 B.Na2FeO
15.1999年1月,江西省赣州地区发生因某重金属元素引起的工业猪油中毒事件,导致中毒的元素是
A.Mg B.Sn C.Ca D.As
16.①农业生产中农药、化肥使用不当 ②生活中大量使用含磷洗涤剂 ③工业生产中废气、废液、废渣排放不当 ④生活污水的任意排放 ⑤石油运输过程中因泄漏流入江河 ⑥原子核反应的残留物随意排放。以上可以造成水污染的是
A.①③⑤⑥ B.①③④⑤ C.①②③⑥ D.全部都是
17.1838年3月纽卡尔市的一些园艺家访问大物理学家法拉第,向他请教一个奇特而有趣的问题:为什么别处生长的紫罗兰都是紫色的,而生长在纽卡斯尔市的紫罗兰却是白色的?法拉第经过一番研究,得出结论,后来被化学家证实并在工业上广泛应用。法拉第的结论是
A.遗传变异 B.纽卡斯尔市民用自来水浇花
C.施花肥不当 D.纽卡斯尔空气中SO2含量较高
18.国家规定从
A.汽油中绝不含铅元素 B.汽油中不人为添加含铅元素的物质
C.汽油中含铅元素在一定指标范围内 D.以上都不正确
19.常见的大气污染分为一次污染物和二次污染物。二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下,发生变化所生成的新污染物。下列4种气体:①SO2,② NO,③NO2,④Cl2中,能导致二次污染的是
A.①②③④ B.只有①②④ C.只有②④ D.只有②
20.油井发生火灾,产生大量废气:①浓烟中的炭粒,②氮的氧化物,③碳的氧化物,④硫的氧化物,⑤碳氢化合物,其中对大气造成污染并导致雨水酸化的有害气体是
A.①②③ B.②④ C.②③④ D.②④⑤
21.“漂尘”是物质燃烧时产生的粒状漂浮物,颗粒很小(直径小于10-
A.氧化剂 B.还原剂 C.吸附剂 D.催化剂
22.汽车尾气中污染空气的是:①CO,②CO2,③NO,④铅的化合物
A.①② B.①③ C.③④ D.①③④
23.使用化学方法可以用消除某些环境污染,下列措施属于化学方法的是
A.废旧塑料重熔、重新成型 B.用多孔吸附剂清理水面油污
C.在燃煤中加入氧化钙 D.将垃圾深埋
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
答案
24.1mol氢气燃烧时约放热286kJ,而每公斤汽油燃烧时约放热16000kJ。氢气被公认为是21世纪替代矿物燃料的理想能源。试简述氢气作为能源的三个主要优点:
(1)________________________________;(2) ________________________________;
(3) ________________________________。
25.某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如下:
时间
开始
8h
16h
24h
32h
40h
48h
pH
5.0
4.8
4.5
4.3
4.2
4.0
4.0
简答:
(1)放置时,雨水样品pH变化的主要原因。_______________________________
(2)pH变化的化学方程式:
________________________________或________________________________。
(3)为减少酸雨的产生,你认为可采取的措施是 。①减少以煤作为燃料;②把工厂的烟囱建得高一些;③将燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源。
A.①③⑤ B.②③④⑤ C.①②③ D.①③④⑤
26.环境监测测定水中溶氧的方法是:①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH =2MnO(OH)2(该反应极快)。②测定:开塞后迅速加入1~2mL浓H2SO4(提供H+)使之生成I2,再用bmol/L的Na2S2O3溶液与生成的I2反应,消耗Na2S2O3VmL,有关反应方程式为:
MnO(OH)2+2I―+4H+=Mn2++I2+3H2O I2+2S2O32-=2I―+ S4O62-
水中溶氧的计算式是_____________________。
27.人类的活动所产生的一些气体,能对大气中的臭氧层起到破坏作用。臭氧含量减少,将造成严重后果,直接威胁到人类的生活和生存。近些年来,屡有在南、北极,甚至西藏的喜马拉雅山地区出现臭氧黑洞的报道,引起人们的极大关注。
简要说明人类活动产生的哪些气体对大气臭氧层能起破坏作用。
28.某工厂排出的废水中含有游离氯,为除去该废水中的游离氯,而且使废水变为中性,有人提出如下图方案:

在废水管的A、B处分别注入一定量的废烧碱溶液和亚硫酸钠溶液。已知:
Cl2+Na2SO3+H2O=Na2SO4+2HCl 请写出:
(1)A、B处分别加入的物质的分子式:A___________________,B__________________。
(2)写出该反应的化学方程式:
A处:_____________________, B处:_____________________。
29.在一烧杯中盛有100mL2mol/LH2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如下图所示)。向该烧杯里缓缓注入0.4mol/L的Ba(OH)2溶液至恰好完全反应,在此实验过程中:
 (1)烧杯里观察到的实验现象是:
(1)烧杯里观察到的实验现象是:
①_____________ _____________;
②_______________ ___________________
(2)写出实验过程中反应的离子方程式:__________________________________。
30.科学家们认为,“温室效应”将对人类产生较大影响,防止温室效应进一步发展
的有效措施有:(1) ,
(2) 。
31.燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤
SO2的污染。
(1)使排放的烟气通过氨水洗涤,化学方程式是 。(2)在煤中加适量石灰,使SO2与石灰反应,化学方程式为 , 该生成物仍可被氧化而成稳定的石膏,化学方程式为 。
32.含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒
杀鱼类。处理它的方法是用氧化法使其转化为低毒的氰酸钾(含CNO-),氧化剂常用次氯酸盐,且进一步可降解为无毒的气体。近期研究将把某些半导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)氰化物经处理后产生的无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为
。
33.在一条鱼、虾几乎绝迹的小河边从上游到下游依次有四座工厂:甲、乙、丙、
丁,它们排出的废液里,每厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某
中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍清。请回答:
(1)四座工厂排出的废液里含有的污染物是:甲 ,乙 ,丙 ,丁 。
(2)小河中鱼、虾几乎绝迹的原因是 。
34.NO是大气污染物之一,目前,有一种治理方法是在
的情况下,用氨把NO还原为N2和水,请写出该反应的化学方程式 。
35.某硫酸厂周围的空气含有较多二氧化硫,为了测定空气中二氧化硫的体积分数做了如下实验:
取上述标准状况下的空气
后在此溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗净、干燥后称重为
(1)通入足量溴水的目的是:
(2)加入过量BaCl2溶液的目的是
(3)过滤后,若在滤液中加K2SO4溶液,有白色沉淀产生,证明:
(4)用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无沉淀出现,证明:
(5)空气中,SO2的体积分数为 。(写清楚具体的计算过程)
参考答案
一、1B、2C、3D、4C、5C、6C、7C、8D、9A、10AB、11D、12DF、13A、14C、15B、16D、17D、18BC、19A、20C、21D、22D、23C、
二、24.(1)相同质量的氢气燃烧时放出的热量比汽油大 (2)氢气燃烧的产物是水,对环境没有污染 (3)制取氢气可以用水,来源十分丰富
25.(1)雨水样品里的中强酸H2SO3和SO2不断被空气中的氧气氧化生成强酸H2SO4,所以,pH随时间延长而H+浓度增大,pH下降,至全部氧化后,溶液中形成H2SO4,不会氧化和挥发,pH不再发生变化 (2)2SO2+2H2O+O2=2H2SO4或2H2SO3+O2=2H2SO4 (3)A.
26. x= b×V×l0―3/4mol
27.喷气飞机排放大量的NO,一些农药、杀虫剂能排放N2O,作为制冷剂在制冷系统中广泛使用的氟利昂等。
28.(1)A: Na2SO3; B:NaOH
(2) A处:Cl2+Na2SO3+H2O=Na2SO4+2HCl, B处:HCl +NaOH=NaCl+ H2O
29.(1)①溶液里产生白色沉淀②小球下沉 (2) Ba2++2OH―+2H++SO42―=BaSO4↓+2H2O
30.(1)寻找并使用新能源 (2)植树造林,扩大绿色植物的覆盖面
31.(1)SO2+2NH3+H2O=(NH4)2SO3
(2)CaO+SO2=CaSO3; 2CaSO3+O2 +4H2O=2 (CaSO4?2H2O)
32.(1)催化剂 (2)CO2; N2 (3)NaClO+NaCN=NaCl+NaCNO
 33.(1)Ca(OH)2 ; FeCl3 ; HCl ;
Na2CO3 (2)河水酸性较强,污染严重
33.(1)Ca(OH)2 ; FeCl3 ; HCl ;
Na2CO3 (2)河水酸性较强,污染严重
34.4NH3+6NO 5N2+6H2O
35.(1)将SO2全部氧化成SO42-:SO2+Br2+2H2O=H2SO4+2HBr
(2)使SO42-完成生成BaSO4沉淀:Ba2++SO42-=BaSO4↓
(3)所加BaCl2溶液已过量 (4)BaSO4沉淀已洗净
(5)2.24% n(SO2)
= n (CaSO4)=  =0.001mol
=0.001mol
V(SO2) = n(SO2)×Vm=0.001mol×
SO2的体积分数= ×100%=2.24%
×100%=2.24%
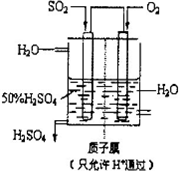 (2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:SO2+
| 1 |
| 2 |
(1)在T1温度时,该反应的平衡常数K=
| 10 |
| 3 |
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是
A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2
C.降低温度
D.在其他条件不变时,减小容器的容积
(4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
(5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,
c(C
| ||
c(S
|
CO(g)+2H2(g)
 CH3OH(g)△H
CH3OH(g)△H(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为
(2)在100℃压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的平衡常数K=
| V2 |
| a2 |
| V2 |
| a2 |
(3)要提高CO的转化率,可以采取的措施是
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同)
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
①c1、c2、c3的关系表达正确的为
A c3>2c1 B c1<c3<2c1 C c1=c2
②a、b、c的关系表达正确的为
A c<2|△H|B a+b=|△H|C c=2b
③p1、p2、p3的关系不正确的为
A p1=p2 B p2<p3<2p2 C p3>2p2
④a1、a2、a3的关系表达不正确的为
A a1=a2 B a3<a2 C a1+a2=1.
(23分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g)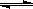 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡 (向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度 D.恒容充入H2
E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平衡 时的 数据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
①c1、c2、c3的关系表达正确的为
A.c3>2c1 B.c1<c3<2c1 C.c1=c2
②a、b、c的关系表达正确的为
A.c<2|△H| B.a+b=|△H| C.c=2b
③p1、p2、p3的关系不正确的为
A.p1=p2 B.p2<p3<2p2 C.p3>2p2
④α1、α2、α3的关系表达不正确的为
A.α1=α2 B.α3<α2 C.α1+α2="1" 查看习题详情和答案>>
(19分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)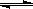 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250°C |
300°C |
350°C |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡___ __(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
|
平 衡 时 的 数 据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
① c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
②p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
③ a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
查看习题详情和答案>>
(23分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g)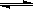 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250°C |
300°C |
350°C |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡 (向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度 D.恒容充入H2
E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
|
平衡 时的 数据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为
A.c3>2c1 B.c1<c3<2c1 C.c1=c2
②a、b、c的关系表达正确的为
A.c<2|△H| B.a+b=|△H| C.c=2b
③p1、p2、p3的关系不正确的为
A.p1=p2 B.p2<p3<2p2 C.p3>2p2
④α1、α2、α3的关系表达不正确的为
A.α1=α2 B.α3<α2 C.α1+α2=1
查看习题详情和答案>>